Gastro-entérologie
Publié le 08 juil 2008Lecture 9 min
Les inhibiteurs de la pompe à protons sont-ils toujours anodins chez l'enfant ?
F.GOTTRAND, Hôpital Jeanne de Flandre, Lille
Les inhibiteurs de la pompe (IPP) à protons sont des molécules apparues il y a une vingtaine d’année, qui ont de puissantes propriétés antisécrétoires gastriques. Par l’inhibition de la sécrétion acide, ils sont indiqués dans les maladies peptiques (œsophagite, gastrite, ulcère) où ils permettent la sédation des symptômes, la cicatrisation des lésions muqueuses et la prévention des récidives (1). Leur utilisation chez l’enfant est, comme chez l’adulte, beaucoup développée compte tenu d’un rapport bénéfice/risque très favorable. Ils ne sont néanmoins pas dénués complètement d’effets indésirables et actuellement en pratique parfois prescrits en excès, ce qui justifie cette mise au point.
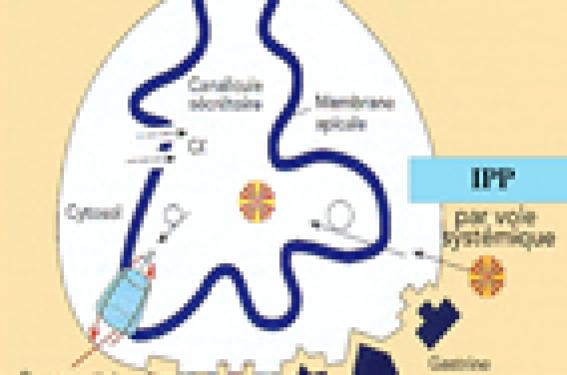
Mécanismes d’action pharmacocinétique Les IPP ingérés ou injectés sous forme de pro-drogue inactive, sont activés en présence d’un pH acide au niveau des canalicules sécrétoires des cellules fundiques. Cela explique donc la raison de la présentation par voie orale sous forme de gélules ou de granules gastroprotégés ; dans le cas contraire, ou si les granules, ou les gélules sont écrasés (pour être administrés aux enfants par exemple), l’activation du médicament a lieu dans la lumière de l’estomac, et donc le médicament est inefficace pour bloquer la pompe à proton en intracellulaire. La forme activée (sulfénamides) des IPP se fixe sur les groupes sulfydril et crée des liaisons covalentes irréversibles avec la pompe à proton, responsable d’une inhibition de la sécrétion gastrique prolongée (36 à 50 heures) (figure 1). Figure 1. Mécanisme d’action des IPP, bloquant la pompe à protons par voie systémique. Leur absorption par voie digestive est rapide et leur demi-vie courte (de 1 à 4 heures). Leur catabolisme est hépatique et utilise la voie du cytochrome P450. Leur élimination est à la fois urinaire et biliaire et il n’y a pas de modification de la pharmacocinétique en cas d’insuffisance rénale, d’hémodialyse et d’insuffisance hépatique. Il existe par contre une très grande variabilité interindividuelle de pharmacocinétique, en particulier chez le nourrisson. Ils présentent peu d’interactions médicamenteuses : avec le kétoconazole dont ils diminuent les taux sanguins, la digoxine – dont ils augmentent les taux sanguins –, et les enzymes pancréatiques – dont ils augmentent la biodisponibilité (cette association est parfois utilisée dans la mucoviscidose pour aider au contrôle d’une stéatorrhée importante). Les IPP inhibent potentiellement l’absorption des médicaments pH-dépendant (comme le fer, cf. infra). Il existe une très grande variabilité interindividuelle de pharmacocinétique des IPP, en particulier chez le nourrisson. Indications des IPP chez l’enfant Les indications des IPP se sont progressivement élargies avec l’expérience (tableau 1). Tableau 1. Principales indications des IPP chez l’enfant. Œsophagite peptique ulcérée (AMM > 1 an) Prévention récidive œsophagite ulcérée (AMM > 12 ans) Traitement RGO symptomatique (AMM > 12 ans Gastrite à Helicobacter pylori (en association avec des antibiotiques) Ulcère gastroduodénal Gastrite non H. Pylori Prévention et traitement des hémorragies digestives dans les situations de stress Actuellement seules trois molécules ont l’autorisation de mise sur le marché chez l’enfant en France : • l’oméprazole pour l’œsophagite ulcérée chez l’enfant de plus de 1 an ; • l’esoméprazole et le pantoprazole chez l’enfant de plus de 12 ans dans les indications d’œsophagite peptique, de prévention des récidives d’œsophagite, mais aussi du RGO symptomatique. Tolérance La tolérance à court terme des IPP est excellente. Comme chez l’adulte les principaux effets secondaires observés sont modérés, transitoires et non liés à la dose (2) : diarrhée, douleurs ab-dominales, céphalées, réactions allergiques cutanées (rares), syndrome confusionnel (rare), hépatite (quelques cas), fulminante (1 cas). Le recul est par contre encore insuffisant chez enfant pour évaluer la tolérance à long terme, d’autant qu’il n’y a actuellement pas d’indication « officielle » de traitement au long cours chez l’enfant. Les effets potentiels observés concernent la modification de la flore intestinale, l’augmentation des infections respiratoires et intestinales, l’augmentation du taux de gastrine et des tumeurs carcinoïdes, les polypes gastriques, l’atrophie gastrique en particulier liée au statut H. pylori, et les troubles de l’absorption du fer. Modification de la flore digestive Une pullulation microbienne a été démontrée dans l’estomac et le duodénum chez l’adulte recevant des antisécrétoires. Les conséquences cliniques restent cependant discutées : augmentation des infections respiratoires et intestinales (cf. infra), production de composés nitrosamines carcinogènes (bien qu’il n’y ait jamais eu de cancer de l’estomac imputé à la prise d’IPP chez l’adulte) (3). Aucune donnée n’est disponible chez l’enfant ! Infections respiratoires et digestives Il a été démontré chez l’adulte que la prise d’IPP augmentait le risque de pneumopathie communautaire (RR = 1,89 [IC 95 % 1,36-2,62]) (4). Chez l’enfant, une seule étude est disponible, dont la méthodologie n’est pas exempte de défaut (5). Elle montre cependant une augmentation de la prévalence des diarrhées de 20 % sur les 4 mois précédant le traitement antisécrétoire (IPP ou anti-H2) à 47 % pendant le traitement, alors que cette prévalence n’augmentait pas dans une population témoin sans antisécrétoire pendant la même période d’observation. De même, la prévalence des pneumopathies augmentait de 3 à 11 % pendant le traitement antisécrétoire alors que cette fréquence restait à 1-2 % dans le groupe témoin (5). Augmentation du taux de gastrine et des tumeurs carcinoïdes Du fait même du mécanisme d’action des IPP, une augmen-tation par un facteur 2 à 5 de la gastrinémie est observée. Le traitement par IPP induit également de façon constante une stimulation des cellules entérochromaffines avec parfois hyperplasie de ces cellules. Cependant, il n’existe qu’une seule observation rapportée chez l’adulte d’une hyperplasie des cellules entérochromaffines associée à une tumeur carcinoïde. Polype gastrique Une hypertrophie des cellules pariétales gastriques (protrusion cytoplasmique, hypertrophie cytoplasmique et nucléaire) est fréquente chez l’adulte traité par IPP et a aussi été décrite chez l’enfant, même après quelques jours d’IPP intraveineux (6). Ceci peut se traduire par des kystes fundiques et des polypes gastrique (figure 2). Ces polypes sont décrits chez l’enfant, sans risque de dégénérescence et sont réversibles lentement après arrêt des IPP (7). Figure 2. Vue endoscopique de polypes gastriques au niveau fundique chez un enfant de 11 ans sous IPP depuis 3 ans. Atrophie gastrique Ce risque a été bien évalué chez l’adulte, et est d’autant plus important que le patient est infecté par H. pylori. Ainsi par exemple, dans une étude de 230 adultes (âge moyen 63 ans) sous IPP depuis 6,5 ans, l’incidence de l’atrophie gastrique était de 4,3 %/an si le sujet était infecté par H. pylori et de 0,7 %/an s’il était H. pylori négatif(8). Dans cette population âgée, peu de métaplasie intestinale et pas d’adénocarcinome étaient observés (8). Aucune observation d’atrophie gastrique ou de métaplasie intestinale n’a été rapportée chez l’enfant traité par IPP (9). Aucune observation d’atrophie gastrique ou de métaplasie intestinale n’a été rapportée chez l’enfant traité par IPP. Troubles de l’absorption du fer En théorie, du fait d’une absor-ption pH-dépendante, le fer, alimentaire ou médicamenteux, devrait être mal absorbé en cas de traitement prolongé par les IPP. En fait, les nombreuses études réalisées chez l’adulte n’ont jamais pu démontrer, même en cas d’atrophie gastrique associée, de malabsorption du fer. Aucune étude n’est disponible à ce jour chez l’enfant, situation où pourtant la carence en fer est fréquente. Utilisation des IPP chez l’enfant L’expérience de l’utilisation prolongée d’IPP en pédiatrie est encore limitée (10, 11) (tableau 2). Il s’agit le plus souvent d’enfants âgés de 4 à 8 ans, présentant un polyhandicap, ou d’autres situations, où le reflux gastro-œsophagien est sévère et prolongé comme dans l’atrésie de l’œsophage. Les effets secondaires observés sont peu fréquents et peu sévères. En revanche, le risque majeur du bon rapport efficacité/risque des IPP est leur prescription en excès. Une étude récente nord-américaine a évalué ce risque chez des nourrissons adressés dans un centre de gastro-entérologie spécialisé pour évaluation d’un reflux gastro-œsophagien (12). Sur les 64 nourrissons adressés pour bilan de régurgitations, 18 (28 %) étaient sous IPP à l’arrivée ; 44/64 ont eu une pH-métrie et seuls 8 avaient un RGO. Après traitement chez 51 enfants, seuls 6 ont présenté une aggravation de leurs symptômes. Le risque majeur du bon rapport efficacité/risque des IPP est leur prescription en excès. Conclusion Les IPP ont une bonne tolérance et un bon rapport bénéfice/risque. Une extension de leurs indications (par exemple au reflux gastro-œsophagien sans œsophagite, aux nourrissons de moins de 1 an) est attendue chez l’enfant dans les prochains mois. L’expérience de leur utilisation prolongée augmente en pédiatrie (mucoviscidose, atrésie oesophage, polyhandicap). Le recul dans ces indications reste cependant encore court chez l’enfant, incitant à la prudence, en particulier dans des prescriptions très prolongées. Le risque majeur, déjà observé en pratique et probablement majoré après l’élargissement attendu des indications, est une prescription trop large et inappropriée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :







