Publié le 03 juil 2007Lecture 18 min
Suivi des anorexies mentales
B. Estour, N.Germain, C.Bossu, B.Galusca - Service d’endocrinologie - CHU St Etienne
L’anorexie mentale est une pathologie fréquente du sujet jeune. Elle fait partie des troubles du comportement alimentaire. Les conséquences métaboliques, hormonales et viscérales, psychiques et sociales sont invalidantes. Parmi elles, nous nous focaliserons sur l’insuffisance gonadotrope.
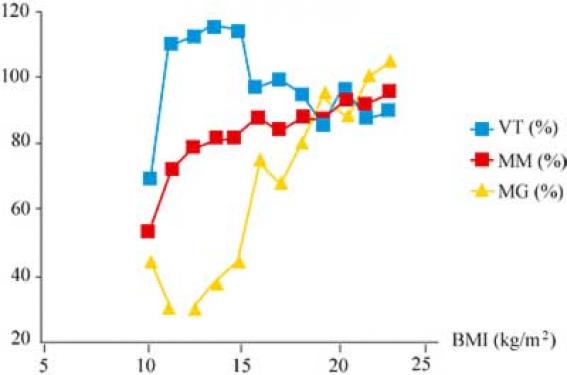
Définition La définition de l’anorexie mentale (AM) a évolué dans le temps entre les critères proposés dès 1985 par Russell, définitivement établis en 1994, et publiés par l’American Psychiatric Association dans le Diagnostic and Statistical Manual of Mental Disorders (DSM IV) (1). Il existe quatre critères : refus de maintenir un poids corporel au-dessus d’un poids minimum pour l’âge et la taille ; peur intense de prendre du poids ou de devenir gros, alors que le poids est inférieur à la normale ; perturbation de l’estimation de son poids corporel ou de ses formes, entraînant une influence excessive sur l’estime de soi, ou un déni de la gravité chez la femme, une aménorrhée secondaire de plus de 3 cycles, ou une aménorrhée primaire ; de plus, l’interrogatoire doit rechercher des épisodes de boulimie (binge eating) pour définir « l’anorexie boulimique » par opposition à « l’anorexie restrictive ». La prévalence d’environ 50/100 000 et l’incidence sont discutés. Les TCA seraient rencontrées dans 1 à 2 % de la tranche d’âge 15-25 ans, avec, dans la moitié des cas, l’existence d’une AM restrictive. Cependant, l’AM représente la première cause d’amaigrissement à cet âge. Diagnostic Le diagnostic clinique de l’AM restrictive est facile à porter au cours de l’examen clinique et de l’entretien. On décrit une maigreur diffuse secondaire à un amaigrissement, une peau sèche et cartonnée, une bradycardie pouvant atteindre 35 pulsations par minute, une cyanose des extrémités (nez, mains, pieds) à type de pseudosyndrome de Raynaud, un lanugo, une hypothermie entre 35° et 36°. La parotidomégalie, rare, témoigne de purges associées. À l’interrogatoire, on retrouve un profil psychologique associant maîtrise (je fais ce que je dis), perfectionnisme (dans le travail et sur le corps), persévérance (entre autre dans le travail scolaire), ce qui favorise l’isolement social, perte de contact avec la réalité ou déni (je mange, je ne suis pas maigre), peu de dépression ou d’anxiété, perte de la préoccupation sexuelle et, dans la moitié des cas, une hyperactivité physique servant à augmenter consciemment la dépense énergétique. Le diagnostic différentiel permet d’éliminer les amaigrissements cachectisants (hémopathie, infections), les maigreurs psychogènes (avec syndrome dépressif), la maigreur constitutionnelle (sans aménorrhée, ni perte de masse grasse, ni anomalies hormonales décrites par la suite) (2), et les aménorrhées atletica qui sont parfois difficiles de différencier de l’anorexie mentale du sportif. Le syndrome nutritionnel L’amaigrissement de l’AM est très spécifique, car il est progressif, souhaité, nié, supporté. Ces caractéristiques expliquent les deux étapes que traversent les familles, un retard de diagnostic, suivi d'une anxiété intense devant l'ampleur de la dénutrition. Les conséquences nutritionnelles sont multiples et d’intensités proportionnelles à l’indice de masse corporel (IMC). Le seuil de poids au-dessous duquel on peut parler d’AM dépend du poids génétiquement programmé. Habituellement, le chiffre d’IMC inférieur à 17,5 kg/m2 est retenu, mais il n’entre clairement dans aucune définition. La perte de masse grasse L’AM présente une dénutrition très spécifique qui concerne préférentiellement la masse grasse dès le début de l’amaigrissement, et qui ne réduit la masse maigre que pour un IMC inférieur à 16,5 kg/m2. Pour un IMC entre 14,5 et 16,5 kg/m2, les valeurs mesurées par DEXA donnent 10 % pour la masse grasse vs 25 % dans un groupe témoin apparié par l’âge, alors que le pourcentage de masse maigre est le même (tableau 1). Tableau 1.Paramètres nutritionnels et hormonaux de 60 adolescentes anorexiques âgées de 15 à 20 ans, de 55 adultes âgées de 20 à 30 ans et de 19 adultes témoins (valeurs moyennes ± SEM). a Différence significative (p < 0,05) vs adultes témoins. * Différence significative (p < 0,05) vs AM adultes ** p = 0,053 vs AN adultes. Pour GH, cortisol, ostéocalcine, CTX et leptine, la valeur donnée est la moyenne des résultats des prélèvements à 8 h,12 h,16 h, 20 h, 24 h, 04 h. BMD : bone mineral density ; CTX : marqueur de résorption osseuse ; ostéocalcine : marqueur de formation osseuse. L’impédancemétrie donne des résultats assez semblables à ceux du DEXA, mais mesure en plus l’eau totale, qui peut parfois être élevée, et apporte une rectification sur l’appréciation du poids donné par la balance. La conservation de la masse maigre va de pair avec le maintien, ou parfois l’excès, de l’activité physique (figure 1). Figure 1. Évolution du volume total d'eau (%), masse grasse (MG) et masse maigre (MM). Les marqueurs nutritionnels Ceux habituellement rapportés dans des états de cachexie infectieuse, néoplasique, comme la préalbumine, ne sont pas modifiés. Ainsi, le cholestérol total est normal. En revanche, tous les auteurs retrouvent un syndrome de « basse T3 » avec, en miroir, une élévation de la reverse T3, une IGF 1 abaissée, une SHBG élevée(3) et des anomalies qui se normalisent avec la reprise de poids. La dépense énergétique L’enquête alimentaire est difficile à faire dans ce contexte de déni de la maladie. Il en ressort des résultats à prendre avec précaution. Dans notre expérience, on trouve un apport de 1 100 kcal/j vs 1 950 kcal/j dans un groupe contrôle, constitué de 30 % de lipides (vs 38 %), de 19 % de protéines (vs 14 %) et de 50 % d’hydrates de carbone (vs 46 %). La réduction de l’apport en graisse est bien notée dans tous les entretiens, et explique la diminution du pourcentage de masse grasse. En revanche, la dépense énergétique, calculée par la technique de référence à l’eau doublement marquée, est comparable aux témoins (1 900 kcal/j vs 2 100 kcal/j). Cette différence entre les apports et les dépenses explique bien l’amaigrissement progressif (4). La régulation de l’appétit Dans l’hypothalamus, le noyau arqué produit des peptides qui stimulent l’appétit et diminuent la dépense énergétique (Neuropeptide Y et Agouty related peptid), tandis que a MSH et CART (cocaine and amphetamine related transcrip) exercent un effet opposé. Les neurones du noyau arqué sont modulés par des hormones périphériques, principalement sécrétées par le tube digestif ou le tissu adipeux, capable de passer la barrière hémato-méningée. La ghréline, sécrétée par l’estomac ayant un effet orexigène, est élevée dans l'AM. Le polypeptide YY (PYY 1-39 sécrété par l’intestin grêle, ayant un effet anorexigène, est abaissé. Ces deux hormones devraient favoriser la reprise alimentaire qui n’est pas évidente (in press). La leptine, sécrétée par le tissu adipeux, circule à un niveau très bas en accord avec la perte de la masse grasse. L’insuline est effondrée et reste capable de provoquer une hypoglycémie qui stimule l’appétit. Toutes ces hormones ont un niveau adapté à la dénutrition, mais ne sont pas capables de faire prendre du poids à la patiente. Son psychisme de maîtrise semble dominer l’organique hormonal ! Évolution L’évolution est marquée par une mortalité de 2 à 8 % dans les études rétrospectives, chiffre important pour cette tranche d’âge, avec deux pics soit la première année soit tardivement après 15 ans. La guérison, définie par l’association d’une prise de poids supérieur à un IMC de 17,5 kg/m2 poursuivi pendant plus d’un an et le retour physiologique des règles, survient dans environ 50 % des cas. Il faut, en moyenne, 2 ans et demi pour retrouver le poids et 3 ans et demi pour retrouver les règles, qui ne surviennent que lorsque le poids a atteint celui ayant précédé l’épisode de l’AM dans notre expérience(5). Les rechutes apparaissent tout au long de l’évolution préférentiellement dans les trois premières années. Les patientes non guéries se répartissent en deux groupes, l’un dont le poids et le comportement sont compatibles avec une vie sociale même tronquée (30 %) et l’autre désocialisé, à la charge de la famille et des institutions d’aides. Aucun traitement ne fait actuellement l’unanimité. Il doit répondre à des modèles plurifactoriels, associant de la psychothérapie et/ou de la chimiothérapie, rarement des traitements nutritionnels et un accompagnement familial. Il existe des différences culturelles, dogmatiques. Ce qui fait l’unanimité, c’est une prise en charge pluridisciplinaire somatique et psychique sur plusieurs années, par des thérapeutes ayant les moyens de leurs traitements et habitués à cette pathologie et au travail de groupe pour éviter le « clivage »(6). Les principes généraux acceptés sont : l’évaluation physique, psychique et nutritionnelle ; l’établissement d’un coordonnateur pour éviter le nomadisme médical et le clivage ; et la reprise de poids. On peut s’aider de contrats contraignants qui s’opposent au caractère de la patiente : perte de la maîtrise au profit du contrat, mais perfection et persévérance dans le respect des objectifs. En effet, la reprise de poids entraîne un mal être venant de la perte de maîtrise responsable de la jouissance, de la baisse du cortisol hormone psychotonique, et de l’angoisse de la reprise de poids même. Ce contrat, dont les contraintes sont hiérarchisées, peut inclure des hospitalisations longues. Les conseils nutritionnels n’ont que peu de place en début de traitement, car ils peuvent être détournés de leurs sens et être utilisés en contre-message. L’alimentation forcée n’a plus sa place, ce qui évite toutes les complications œdémateuses. Conséquences organiques (tableau) L’axe gonadotrope Il se caractérise par une insuffisance gonadotrope fonctionnelle. La traduction clinique est l’aménorrhée secondaire et l’infertilité de couple. On décrit une diminution des stéroïdes libres 17bE2 et de la testostérone, une disparition de la pulsatilité de LH ainsi qu’une réponse atténuée sous 100 mg de GnRH ou sous clomide. Aucune étude à ce jour n’a confirmé la diminution probable du GnRH hypothalamique. L’aménorrhée secondaire de l’AM peut s’apparenter à un retour à la fonction gonadotrope prépubère. Le démarrage de la puberté est régulé de manière polygénique et fait appel à trois éléments : une inhibition transynaptique : GABA et neurones POMC, une stimulation neuronale par l’intermédiaire de neurones à glutamate et à Kisspeptine, et enfin, la structure gliale, qui est plus qu’un tissu de soutien, puisqu’elle contient des récepteurs pour de multiples hormones telles que la mélatonine, la T4, la 17bE2, la testostérone, la vasopressine, l’ocytocine, le CRF, la leptine, le glucagon et IGF1. L’ovulation qui authentifie le retour de la fonction gonadotrope fonctionnelle nécessite le retour de l’activité pulsatile des neurones à GnRH. Le système Kisspeptine GPR 54 semble très impliqué dans cette pulsatilité. Ces neurones situés dans la région préoptique et le noyau arqué sont capables de sécréter une protéine appelée Kisspeptine. Elle se lie à un récepteur appelé GPR 54, récepteur orphelin jusqu’à la mise en évidence de cette liaison. Cette protéine appelée Métastine-Kiss- peptine était connue. C’est un neuropeptide codé par le gène Kiss 1 connu comme gène suppresseur métastatique. Cette protéine de 54 aminoacides, administrée soit en injection intracérébrale soit en IV, est un puissant stimulus de GnRH. Kisspeptine peut être clivé. La forme à 10 aa stimule directement la LH. La mutation du récepteur GPR 54 entraîne chez l’homme un retard pubertaire et une infertilité. Les stéroïdes sexuels estradiol et testostérone stimulent les neurones Kiss par l’intermédiaire de récepteurs aux estrogènes dans les deux sexes, mais avec deux effets opposés chez la femme : les stéroïdes qui stimulent les neurones Kiss du noyau arqué bloquent les neurones GnRH, alors que les neurones du noyau antéroventral périventriculaire (AVPV) stimulent le GnRH. L’activité du gène Kiss est augmentée par la leptine. Des explications nutritionnelles et hormonales sont avancées pour expliquer la perte de pulsatilité rencontrée dans l’AM et en premier lieu, la dénutrition. Une restriction calorique, volontaire, à 1 000 kcal/j entraîne chez le sujet normal une diminution de la pulsatilité et une anovulation. La reprise de poids chez l’AM entraîne une amélioration des hormones gonadotropes. La stimulation abaissée des neurones GnRH par la leptine et l’effet inhibiteur de l’excès de ghreline, deux hormones de la régulation de la prise alimentaire, sont impliqués. Un essai de traitement par de la leptine recombinante, qui restaure les cycles ovulatoires, confirme ces données(7). Cependant, le retour à un IMC supérieur à 18 kg/m2 n’entraîne un retour des règles que dans 50 % des cas, Aussi, on évoque l’effet du stress sur l’axe gonadotrope. Les endorphines et leur inhibiteur spécifique la naloxone, le Gaba, la sérotonine et le CRF, par son effet inhibiteur, sont autant d’hypothèses de travail, qui ne débouchent actuellement sur aucune thérapeutique favorisant le retour des règles, même si un essai par perfusion de Kisspeptine in vivo chez l’homme a déjà était réalisé. Dans une étude personnelle, on a comparé deux groupes d’AM de même IMC, dont la moitié avait retrouvé ses règles de manière spontanée et l’autre non. Nous n’avons mis en évidence aucune différence entre les deux groupes pour la leptine, la masse grasse, le niveau de cortisol, IGF1 (résultats non publiés). Dans un travail récent, des différences ont été rapportées associant un mélange de paramètres comme la leptine et l’aire sous la courbe du cortisol. Il reste encore des inconnues. Le traitement physiologique, actuellement disponible pour induire une ovulation en vue d’une grossesse, consiste à restaurer la pulsatilité de LH par l’injection en continu pendant plus de 15 jours du GnRH (iv 6 µg ou sous-cutané 20 µg toutes les 90 minutes). Dans notre expérience, on compte 40 % de grossesses à terme pour 6 tentatives, mais des équipes rapportent des chiffres plus élevés. Dans tous les cas, l’aménorrhée secondaire réapparaît après l’accouchement. La perte de la masse osseuse Parmi les complications de l’anorexie mentale restrictive, on retrouve une diminution de la masse osseuse. Cette anomalie a été rapportée pour la première fois en 1985 sous forme de fractures. Depuis, de multiples auteurs ont confirmé cette donnée. Le risque fracturaire est doublé en période péripubertaire et peut être multiplié par sept. La maturation osseuse qui s'opère dans la période péripubertaire est bloquée pendant l'épisode d'anorexie mentale. Soyka rapporte le chiffre de 50 % d'ostéoporose chez les adolescentes ayant eu un bilan lors de leur premier épisode. Ce résultat est acquis par comparaison avec des sujets contrôles. En effet, la détermination de la masse osseuse par la densitométrie osseuse est bien connue après 20 ans. Cette détermination par DEXA est la méthode standard. Cependant, avant l’âge de 20 ans, la masse osseuse est plus difficile à évaluer compte tenu des différences de maturation secondaire à la variation des dates de début de la puberté. Dans notre expérience, nous retrouvons un chiffre de 50 % d'ostéopénie dans une cohorte de 98 patients âgés de 15 à 25 ans, 10 % d’ostéoporose fémorale et 18 % d’ostéoporose rachidienne. Cette ostéoporose touche aussi bien l'os vertébral que le fémur et le radius. Elle est corrélée à la durée de l’AM. Elle n'est pas responsable de fracture dans cette tranche d'âge. Physiopathologie de l'ostéoporose de l'anorexie mentale La diminution de la masse osseuse vient d'un découplage partiellement discuté entre la formation diminuée et la résorption augmentée. Après la première description de Fonseca, tous les auteurs s'accordent sur la diminution de la formation osseuse. L'ostéocalcine, protéine spécifique de l'ostéoblaste, représente un marqueur de la formation osseuse. On décrit un cycle nycthéméral dans l'espèce humaine. Dans l'anorexie mentale dénutrie, nous avons rapporté des valeurs extrêmement basses et un cycle nycthéméral aboli(8). En revanche, il existe des oppositions en ce qui concerne la résorption osseuse. Grinspoon rapporte une élévation de la déoxypiridinoline. Depuis, ce résultat est confirmé pour tous les marqueurs de la résorption osseuse dosés dans les urines ou dans le plasma tel que le CTX sérique (sCTX). Pour notre part, nous retrouvons la conservation du cycle nycthéméral du sCTX, dont les valeurs ont plus que doublées comparativement au contrôle et dans deux tranches d’âge : 15-20 ans et 20-35 ans(9). Au total, l'ostéoporose de l'anorexie mentale résulte d'un découplement entre la formation osseuse très diminuée et la résorption osseuse augmentée. Ce profil osseux est très spécifique de cette pathologie et ne se rencontre dans aucune autre pathologie sauf dans une situation de type apesanteur. Régulation du turn-over osseux Cette régulation est complexe et fait intervenir le rôle des hormones, de la nutrition, de l'exercice physique à côté de la génétique, L'anorexie mentale rassemble une partie de ces paramètres. Sur le plan hormonal, on rapporte un déficit en 17 bêta-estradiol, un hypercortisolisme, un déficit en IgF1 circulant. L'AM présente une maigreur caractérisée par une perte de la masse grasse avec conservation de la masse maigre, déficit en leptine, syndrome de basse T3. Dans une étude récente, nous avons étudié les facteurs prédisant le niveau plasmatique des marqueurs de formation et des marqueurs des résorption, en fonction des niveaux hormonaux et nutritionnels dans un groupe de 95 patientes atteintes d’anorexie mentale en phase de dénutrition. La baisse de l'ostéocalcine est exprimée à 65 % par la baisse de LT3, d'IGF1, et de l'élévation du cortisol. Les marqueurs nutritionnels directs, l’IMC et le pourcentage de masse grasse, n'interviennent pas, lorsque on les fait rentrer dans une équation de régression pas à pas. En revanche, la prédiction de l'élévation du sCTX est plus floue, mais fait intervenir la nutrition (IMC ou masse grasse) IGF1 et 17 bêta-estradiol(9). Ces corrélations peuvent être discutées car la dénutrition en elle-même entraîne des variations hormonales, qui se normalisent avec la reprise de poids. De plus, une équipe suisse rapporte un appauvrissement de la microarchitecture au Scanco (scanner capable de donner une analyse microarchitecturale en trois dimensions de la structure de l’os). Le traitement de l'ostéoporose de l’AM Dans un objectif thérapeutique, la reprise de poids est nécessaire, mais pas suffisante. Elle normalise les marqueurs hormonaux (figure 2). Elle stabilise la masse osseuse. Cependant, deux éléments sont à prendre en compte dans l'anorexie mentale : l'âge et le profil psychologique. Figure 2. L’impact de la reprise de poids sur les marqueurs osseux. Le jeune âge correspond à la phase d'acquisition de l'os. Ceci explique que les complications ne se verront que tardivement. Ce n'est pas le taux de fractures qui sera un élément de suivi dans un protocole thérapeutique, mais l'acquisition de la masse osseuse à la densitométrie osseuse. Le profil psychologique de l’AM contient le frein thérapeutique : la peur de grossir. Cet élément limite la reprise de poids. En conséquence, le traitement de l'ostéopénie de l'anorexie mentale dénutrie est difficile. Il est donc nécessaire de proposer des médicaments associés à la reprise de poids, dont le rôle sera d’influencer le découplage osseux en favorisant la formation et en diminuant la résorption osseuse. De multiples essais thérapeutiques ont déjà été réalisés et ont montré leur faiblesse. Klibanski rapporte qu'un traitement par 17 bêta-estradiol n'améliore la densitométrie osseuse que si les patientes augmentent leur poids. Le traitement hormonal estrogénique isolé n'a pas d'efficacité. Il présente plutôt des effets pervers puisqu’il masque à la patiente et à son entourage la réalité du trouble. IgF1 recombinant à la dose de 100 µg/kg 2 fois par jour améliore significativement les marqueurs de la formation osseuse qui doublent (ostéocalcine 5,3 ± 3,8 à 10,9 ± 7,4 ng/ml), mais amplifie la résorption dont les marqueurs doubles aussi (Pyrx 51,0 ± 16,6 à 87,1 ± 8,2 nmol/mmol créatinine). La DHEA a été proposée, mais les études concordantes manquent. Les biphosphonates isolés (5mg/d) ont amélioré la masse osseuse de 4 % en 10 mois, et diminué les marqueurs de la résorption osseuse de 24 %. C’est la première étude d’intervention positive. Une stratégie logique se doit d’associer des médicaments qui diminuent la résorption, à des médicaments qui augmentent la formation. Aucune stratégie de ce type n’a été entreprise à ce jour
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :