Publié le 22 oct 2007Lecture 8 min
La maladie de Rendu-Osler : tableaux inauguraux chez l’enfant
H. PLAUCHU, C. MOTTOLESE, A. VASDEV, F. TAHON, L. GUIBAUD, M. HERMIER, D. REVEL, S. DUPUIS-GIROD - Hôpital Hôtel-Dieu, Paris
La maladie de Rendu-Osler, ou télangiectasie hémorragique héréditaire, est une maladie rare (< 1/2000) qui quitte son statut de maladie orpheline depuis le complément récent des descriptions des complications survenant surtout chez l’adulte. Depuis la découverte de deux des trois gènes directement responsables de la maladie, l’identification des mutations devient possible et ouvre la voie, non seulement d’un diagnostic familial plus précoce, mais aussi de la reconnaissance de la maladie devant des situations inaugurales, monosymptomatiques chez l’enfant, lorsque la mutation familiale est identifiée.
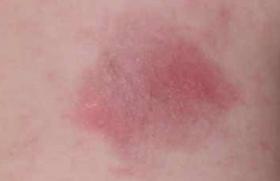
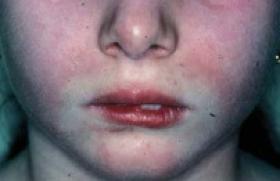
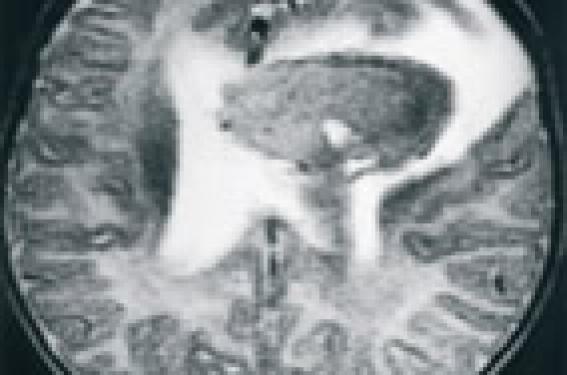
Situations cliniques concrètes De nombreuses situations cliniques possibles chez l’enfant émergent de la cohorte de 500 sujets suivis par le centre de référence maladie de Rendu-Osler créé à Lyon en novembre 2004 dans le cadre du plan maladies rares (tableau) . Situations pédiatriques inaugurales de la maladie de Rendu-Osler. • Insuffisance cardiaque néonatale par MAVC • Cardiopathie cyanogène congénitale • Coma brutal • Hémorragie cérébrale • Compression médullaire lente • Hémiparésie • Épilepsie focalisée • Image ronde du poumon • Paraplégie flasque aiguë douloureuse • Abcès cérébral • Polyglobulie avec cyanose • Dyspnée d’effort, platypnée • Anémie par épistaxis spontanées, récurrentes et banalisées, ou par fistules intestinales précoces • Accident ischémique transitoire Nous en illustrerons quatre : • Survenue à 4 mois d’un coma aigu chez l’enfant A. J… chez qui rien n’était signalé à la naissance et sans aucun trouble prémonitoire. Lors de l’hémostase chirurgicale réalisée en urgence, le chirurgien identifie une fistule artério- veineuse (FAV) sous-pariétale. Avec un recul de 5 ans, la guérison a été obtenue au prix de séquelles très modérées, l’enfant se développant parfaitement bien malgré une légère hémiparésie du membre supérieur gauche et quelques difficultés urinaires (figure 1). Figure 1. A. J…, hémorragie cérébrale à 4 mois. • L’enfant F. R… semble en bonne santé jusqu’à l’âge de 9 ans, du moins sans gêne fonctionnelle, jusqu’à l’apparition d’un abcès cérébral sans porte d’entrée bactérienne retrouvée. Le traitement antibiothérapique seul conduit à la guérison de l’abcès et aucun examen complémentaire n’est entrepris. La maladie de Rendu-Osler n’a pas été « dénichée » chez le père alors que le diagnostic est complet depuis 3 ans. Ce n’est que 12 ans plus tard, lorsque sa soeur, C. R… développe un abcès cérébral que la recherche de FAV pulmonaire est entreprise et révèle l’étiologie identique de ces deux abcès (figure 2). Figure 2. F.R…, abcès cérébral à 12 ans. • L’enfant T. L… est asymptomatique jusqu’à l’âge de 9 ans. Lors d’une dispute en cour de récréation, l’enfant reçoit un coup dans le ventre et se plaint pendant quelques jours de douleurs abdominales qui restent banalisées. Un mois plus tard, il présente une violente douleur abdominale et, en même temps, développe en quelques heures, une paraplégie flasque aiguë. Compte tenu du diagnostic connu de Rendu-Osler chez le père, l’enfant est rapidement traité par embolisation artérielle d’une malformation artério-veineuse médullaire qui, en se rompant, a entraîné une hématomyélie. Cela explique les séquelles importantes sous forme de paraplégie non régressive et de troubles sphinctériens (figure 3). Figure 3. T. L…, paraplégie aiguë à 9 ans. • O. G…, garçon né en 1969, peu sportif, commence à être gêné à l’âge de 8 ans par une cyanose progressive. À 10 ans, une polyglobulie avec hémoglobine à 19 g/dl conduit à une consultation de génétique ciblée. L’examen de la mère révèle 14 télangiectasies punctiformes rendant le diagnostic possible mais permettant de réunir seulement deux signes de la maladie dans une même famille. À l’époque, le traitement chirurgical s’imposait, comme le suggéraient la taille de la fistule (figure 4), l’aspect angiographique (figure 5) et la pièce anatomique. Il y avait un véritable labyrinthe de vaisseaux dilatés dans lesquels il était possible de glisser le petit doigt. Âgé de 33 ans maintenant, ce père de famille n’a pas développé d’autre FAV pulmonaire, mais son premier enfant saigne du nez depuis l’âge de 4 ans et est surveillé comme un Rendu-Osler potentiel. La mutation n’a pas été retrouvée dans cette famille où le diagnostic clinique est complet maintenant. A gauche : figure 4. O.G…, FAVP gauche à 10 ans. A droite : figure 5. Exemple de fistule artério-veineuse pulmonaire avant traitement par vasoocclusion endo-artérielle pulmonaire. Comment arriver au diagnostic ? ● épistaxis spontanées La maladie de Rendu-Osler est une maladie autosomique dominante, ce qui veut dire que tout enfant atteint a, de principe, un parent malade et en âge d’extérioriser l’ensemble des symptômes. C’est chez ce dernier que l’interrogatoire va retrouver, une fois sur deux avant 20 ans, des epistaxis spontanées, récidivantes et responsables d’une anémie chronique. Longtemps supportées sans traitement agressif, ces épistaxis sont souvent banalisées et doivent être recherchées avec insistance (présentes chez 94 % des patients atteints de la maladie)de Rendu-Osler). Lors d’une surveillance établie au moyen d’une grille élaborée par les ORL et l’association Maladie de Rendu-Osler, ces patients sont très souvent mis à un traitement martial au long cours et ne développent pas forcément une complication de la maladie. Les épistaxis sont présentes chez 94 % des patients atteints de la maladie de Rendu-Osler. ● Les télangiectasies constituent le deuxième élément du trépied symptomatique (présentes chez plus de 86 % des patients), leur apparition par florescences tardives, à partir de la trentaine, soulignent la pénétrance incomplète de la maladie avant 50 ans. Ces télangiectasies, planes, punctiformes ou arrondies, de quelques millimètres de diamètre, rouge foncé, siègent dans des zones de prédilection : visage (lèvres cutanées, oreilles, nez et pommettes) et mains (pulpes et zone périunguéale surtout). Elles sont aussi muqueuses, touchant les lèvres, la langue, le pharynx et bien sûr la tache rouge du nez. Les télangiectasies présentes chez plus de 86 % des patients apparaissent à partir de la trentaine. ● Le caractère héréditaire de ces deux signes précédents est présent dans plus de 96 % des familles. Le fonctionnement en dominance autosomique des mutations responsables conduit à retrouver habituellement un des deux parents atteints, et 50 % de l’ensemble des apparentés du premier degré. Les deux sexes sont touchés à égalité et le risque pour la descendance d’un sujet atteint est de 50 %. Il est actuellement prouvé que trois gènes peuvent être responsables de la maladie de Rendu-Osler ; deux sont connus : – l’endogline est responsable d’environ 30 % de la maladie en France ; – l’ALK1 semble responsable de 60 % de la maladie en France. Un troisième gène est localisé sur le chromosome 5 mais n’est pas encore identifié. Un autre gène, SMAD4, est responsable d’une forme syndromique qui associe la maladie à une polypose juvénile. Les fistules artério-veineuses viscérales Les fistules artério-veineuses viscérales (FAV) donnent à la maladie sa morbidité, sa mortalité et ses marques inaugurales trompeuses qui égarent le diagnostic. Les fistules pulmonaires peuvent se déclarer par des manifestations neurologiques. Beaucoup plus rares, les fistules neurologiques semblent pouvoir se révéler précocement et posent un problème de conduite à tenir qui n’est pas encore codifiée. La complication viscérale dépistée par écho-Doppler hépatique ne se manifeste pas cliniquement avant la trentaine, touche surtout la femme et est cliniquement grave chez 1 à 2 % des malades. En pratique, on retiendra Les quatre points essentiels Devant des signes d’appel inauguraux, pulmonaires ou neurologiques, il faut savoir penser à la maladie de Rendu-Osler ! Le diagnostic repose sur l’examen des parents qui ont la clé du diagnostic. Le centre de référence national (www.rendu-osler.fr) et des centres de compétences constitués en réseau développent leur expertise dans le diagnostic et la prise en charge de la maladie dans différentes régions françaises. Chez l’enfant, une attitude de dépistage des risques pneumologiques et neurologiques s’organise et s’adapte à chaque famille. La possibilité de détecter les mutations chez actuellement environ 90 % des malades se justifie chez l’enfant s’il y a « un bénéfice immédiat dans la prise en charge médicale » de celui-ci (décret de juin 2000 d’application de la loi de Bioéthique de 1994).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :