Publié le 25 sep 2014Lecture 9 min
Quoi de neuf sur la prise en charge de l’otite moyenne aiguë du jeune enfant ?
D. GALLAS*, N. TEISSIER** *Service ORL, Groupe hospitalier public du Sud de l’Oise, Senlis/**Service ORL, hôpital Robert Debré, Paris
Dans le cadre du plan national 2011-2016 d’alerte sur les antibiotiques, l’Afssaps souhaite utiliser trois axes stratégiques : l’amélioration de l’efficacité de la prise en charge des patients ; la préservation de l’efficacité des antibiotiques (surveillance de la consommation, de la résistance aux antibiotiques, réduction de la pression sélective des classes antibiotiques les plus inductrices de résistance) et la promotion de la recherche (absence de nouvelle molécule antibiotique depuis longtemps).
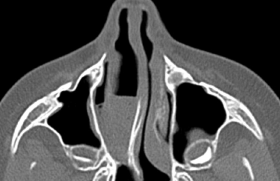
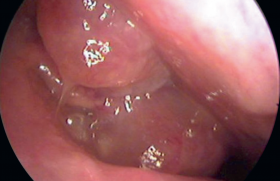
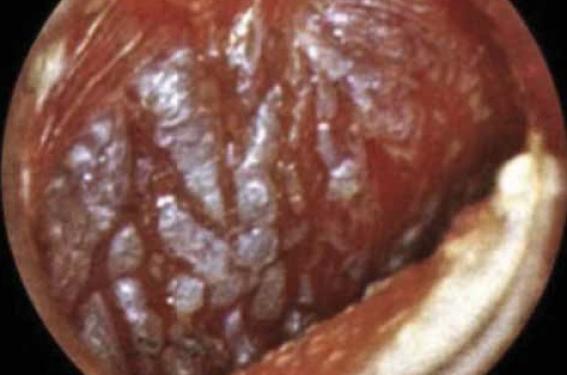
Dans ce contexte, les dernières recommandations concernant la prise en charge des otites moyennes aiguës bactériennes (OMA) datent de 2005. Les modifications de prise en charge de l’OMA résultant de la généralisation de la vaccination antipneumococcique de l’enfant de moins de 2 ans incitent à faire un point sur le sujet en référence aux derniers éléments parus dans la littérature scientifique. L’otite moyenne aiguë (figure 1) est la pathologie la plus fréquemment diagnostiquée qui nécessite la prescription d’antibiotiques chez l’enfant. De nombreuses études nordaméricaines et européennes avaient incité à réserver le traitement antibiotique aux enfants présentant soit des manifestations cliniques importantes lors de l’examen initial, soit une mauvaise évolution clinique après une période d’observation de 3 jours. Ces études avaient conduit à des recommandations officielles de « watchful-waiting strategy » chez les enfants de plus de 2 ans, entre autres aux États-Unis, au Canada, aux Pays-Bas et en Écosse… Figure 1. Otite moyenne aiguë purulente. Le principal biais de l’ensemble de ces études résidait dans des critères d’inclusion otoscopiques qualitativement insuffisants pour le diagnostic de certitude d’une OMA bactérienne. Il est probable qu’était inclus un pourcentage non négligeable d’otites congestives et d’otites séromuqueuses (figure 2), qui ne nécessitent pas d’antibiothérapie et qui évoluent fréquemment spontanément vers la guérison, ce qui diminuait l’écart d’efficacité de l’antibiothérapie vs placebo. D’autres études incluaient des enfants trop âgés. Par ailleurs, la vaccination par le vaccin antipneumococcique conjugué à 7 valences (PCV 7) et plus récemment à 13 valences (PCV 13) de l’enfant de moins de 2 ans modifie la bactériologie et la prise en charge thérapeutique de l’otite moyenne aiguë. Figure 2. Otite séreuse droite avec bulles rétrotympaniques. Faut-il traiter initialement l’otite moyenne aiguë par antibiotiques ? Une récente étude randomisée en double aveugle américaine(1) a inclus 291 enfants âgés de 6 mois à 23 mois, présentant une otite moyenne aiguë sans autre pathologie infectieuse associée, avec des critères otoscopiques stricts (programme de formation spécifique pour les examinateurs). Celle-ci confirme l’efficacité d’un traitement antibiotique démarré dès le diagnostic par amoxicillineacide clavulanique pendant 10 jours (tableau), avec comme seul effet secondaire une augmentation du risque de diarrhées. Une mastoïdite a été observée dans le groupe placebo. Cette efficacité a été aussi observée dans une étude finlandaise(2) réalisée dans les mêmes conditions (randomisation en double aveugle, critères otoscopiques stricts) chez 319 enfants âgés de 6 mois à 35 mois répartis en deux groupes traités par amoxicilline-acide clavulanique pendant 7 jours vs placebo. L’échec du traitement est observé de manière significativement moindre dès le 3e jour (13,7 % vs 25,3 %) et en fin de traitement (18,6 % des cas vs 44,9 %, pour le groupe placebo), au détriment d’une augmentation du pourcentage de diarrhées (47,8 % vs 26,6 %). Une pneumonie et une bactériémie à pneumocoque sévères ont été observées dans le groupe placebo. Évolution bactériologique des otites moyennes aiguës avant et après vaccination antipneumococcique Une étude pédiatrique américaine récente(3) a séparé en trois groupes une population d’enfants âgés de 6 mois à 23 mois atteints d’une otite moyenne aiguë : – groupe 1 : avant la vaccination antipneumococcique à 7 valences (PCV 7) ; – groupe 2 : précocement après PCV 7 ; – groupe 3 : tardivement après PCV 7. Les prélèvements nasopharyngés étudiant le Streptocoque pneumoniae montrent une décroissance progressive des sérotypes inclus dans le PCV 7 : 60,4 % vs 48,6 % vs 5,2 %. Concomitamment, les isolats résistants à la pénicilline (CMI > 0,1 μg/ml) augmentent : 26,7 % vs 37,8 % vs 38,5 %. La proportion du sérotype 19A (non inclus dans le PCV 7 et de sensibilité diminuée à la pénicilline) augmente de 4 % dans le groupe 1 à 25,9 % dans le groupe 3, et le pourcentage de diminution de sensibilité à la pénicilline passe de 0 % à 68,6 % dans le groupe 3. Modifications bactériologiques et thérapeutiques en France En Ile-de-France, l’étude(4) de 3 501 enfants âgés de 6 mois à 24 mois (âge moyen 13,5 ± 5 mois) présentant une otite moyenne aiguë entre 2006 et 2010 a permis de faire le point sur l’évolution bactériologique des prélèvements nasopharyngés. Au total, 98 % de ces enfants étaient vaccinés par le PCV 7, 41,3 % étaient gardés en crèche ; 47,3 % avaient reçu une antibiothérapie dans les 3 mois précédant l’inclusion (céphalosporine : 22,6 %, amoxicilline-acide clavulanique : 19,2 %) ; 57,9 % de pneumocoque et 48,2 % d’Hemophilus influenzae ont été isolés. En outre, 46,3 % des pneumocoques sont de sensibilité diminuée à la pénicilline (42,4 % intermédiaires, 3,9 % résistants). L’existence d’au moins deux traitements antibiotiques précédant l’inclusion multiplie le risque de résistance du pneumocoque par 2,6 ; le mode de garde en crèche de 1,5. Pour Hemophilus influenzae, 17,1 % des souches sont productrices de bêtalactamases (BL+) et 7,7 % sont résistants aux bêtalactamines par modification des protéines de liaison à la pénicilline (BLNAR+). Trois facteurs augmentent le risque de portage de souche d’Hemophilus influenzae BL+ ou BLNAR + : âge inférieur ou égal à 12 mois (Odds Ratio [OR] = 3,5), l’usage de céphalosporine orale avant inclusion (OR = 2,5), la prescription avant l’inclusion d’au moins deux cures d’antibiotiques (OR = 3,1). Une étude française multicentrique(5) à propos de 143 enfants (âge moyen 16,9 ± 9,9 mois), examinés en ORL entre 2007 et 2009 et en échec thérapeutique d’une otite moyenne aiguë, a retrouvé 35 % d’examens bactériologiques stériles ; parmi les 28 % de pneumocoques isolés (à 84,5 % de sérotype 19 A) 4,4 % sont sensibles, 77,8 % sont intermédiaires et 17,8 % sont résistants à la pénicilline; parmi les 24 % des Hemophilus influenzae isolés, 15,5 % BL+ et 35,5 % BLNAR+. Comme cela était prévisible, la vaccination par le PCV 7 a modifié le portage bactériologique nasopharyngé de l’enfant et la bactériologie de l’otite moyenne aiguë, en faisant apparaître des souches pneumococciques qui n’étaient pas présentes dans ce vaccin (en particulier la 19 A). L’apparition récente du PCV13 avec vaccination de rattrapage devrait diminuer dans l’avenir le portage de ces souches. Toutefois, il est vraisemblable qu’apparaîtront de nouvelles souches non incluses dans la dernière version, qui nécessiteront la poursuite des études bactériologiques. La prise en charge thérapeutique de l’otite moyenne aiguë du jeune enfant se doit d’être adaptée en réservant la prescription d’antibiotiques exclusivement aux otites moyennes aiguës confirmées (le facteur limitant principal étant la qualité de l’otoscopie). Consécutivement à ces modifications bactériologiques en France (diminution de la proportion de souches d’H. influenzae BL+, et augmentation des souches de pneumocoques à sensibilité intermédiaire à la pénicilline), il y a nécessité à envisager la réduction de la prescription des céphalosporines orales, en privilégiant, suivant le contexte clinique, la prescription d’amoxicilline (dont la dose pondérale doit être adaptée en cas de suspicion de diminution de sensibilité à la pénicilline) éventuellement associée à l’acide clavulanique. Recommandations thérapeutiques pour l’otite moyenne aiguë du jeune enfant en France L’amoxicilline à la dose de 80-90 mg/kg/j en 2 à 3 prises quotidiennes reste efficace sur le pneumocoque de sensibilité diminuée à la pénicilline. Si le temps entre les prises ne peut être équidistant de 8 heures, il est préférable de répartir la dose en deux prises, afin de privilégier une concentration sérique le plus longtemps au-delà de la CMI. Pour H. influenzae (responsable de 30 % des otites), il n’y a pas de différence d’activité entre l’amoxicilline et l’association amoxicilline- acide clavulanique sur les souches BLNAR. La différence d’activité entre les deux sur les 17 % de souches BL+ n’intéresserait actuellement qu’environ 5 % des otites (avec guérison spontanée dans la moitié des cas). Traitement de première intention Ainsi, la SPILF(6) recommande en première intention l’amoxicilline à la dose de 80-90 mg/kg/j en 2 à 3 prises, pendant 8 à 10 jours chez l’enfant de moins de 2 ans, et pendant 5 jours après 2 ans. Les autres antibiotiques ont un rapport bénéfice-risque moindre (efficacité moindre et/ou majoration des effets indésirables). Peuvent être proposés : – l’association amoxicilline-acide clavulanique en cas de syndrome otite-conjonctivite (forte probabilité d’H.influenzae) ; – cefpodoxime en cas d’allergie vraie aux pénicillines sans allergie aux céphalosporines (le céfuroxime-axétil, moins bien accepté dans sa forme pédiatrique, avec mauvaise adhérence au traitement n’est plus recommandé ; – érythromycine-sulfafurazole ou cotrimoxazole en cas d’allergie vraie aux pénicillines et céphalosporines ; – ceftriaxone en une seule injection IM ne doit être réservée qu’à l’impossibilité d’un traitement oral. Prise en charge des échecs du traitement antibiotique Soit l’aggravation ou la persistance au-delà de 48 heures des signes généraux ou fonctionnels avec persistance de signes otoscopiques d’otite moyenne aiguë, soit la réapparition de ceux-ci 4 jours après la fin du traitement antibiotique. • Si l’amoxicilline est le traitement de première intention : – échec en cours de traitement : amoxicillineacide clavulanique ou cefpodoxime ; – échec en fin de traitement : amoxicillineacide clavulanique ; – 2e échec : avis ORL recommandé pour discuter d’une paracentèse à visée bactériologique alors associée à un traitement probabiliste en attente de la bactériologie : association amoxicilline-acide clavulanique (80 mg/kg/j) d’amoxicilline + amoxicilline (70 mg/kg/j) ou ceftriaxone IM (50 mg/ kg/j) pendant 3 jours. • Si l’amoxicilline n’est pas le traitement de première intention : avis ORL recommandé pour discuter d’une paracentèse à visée bactériologique.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :