Infectiologie
Publié le 14 mar 2018Lecture 5 min
Le Chikungunya chez l’enfant : quelle évolution ?
P. GÉRARDIN Pôle femme-mère-enfant, CHU & Inserm, CIC 1410 (CHU), Saint-Pierre, Réunion ; UM 134 “Processus infectieux en milieu insulaire tropical”, CNRS 9192, Inserm U1187 IRD 249, Université de la Réunion, CYROI, Sainte-Clotilde, Réunion
Le Chikungunya est une arbovirose en expansion dans le monde du fait de la plasticité de son agent pathogène, le virus Chikungunya (CHIK-v), un alphavirus mutant à ARN rendant la vaccination difficile, mais aussi de la plasticité de ses vecteurs, les moustiques femelles du genre Aedes (Stegomya), capables de s’adapter à des environnements différents. Cet article résume les connaissances sur l’épidémiologie et l’expression clinique du Chikungunya chez l’enfant, en confrontant les résultats acquis lors des deux récentes grandes vagues épidémiques dues à 2 génotypes différents du virus.
Introduction
Parmi les arboviroses d’intérêt pédiatrique, la fièvre Chikungunya (Cf), du fait de l’expansion mondiale de ses vecteurs des moustiques anthropophiles du genre Aedes (Ae.), est avec la dengue et le Zika, celle qui a acquis le plus fort potentiel pandémique et épidémique(1). Le virus Chikungunya (CHIK-v) est un alphavirus de la famille des Togaviridae, dont il existe trois génotypes : l’Asiatique, l’Ouest-Africain et l’Est Central Sud Africain (ECSA). Depuis la réémergence en 2004 dans les îles de l’Océan indien d’un variant de l’ECSA, baptisé IOL (Indian ocean lineage), plus de 2 millions de cas ont été enregistrés en Inde, en Indonésie, en Asie du Sud Est, ainsi qu’en Chine, aux Philippines et en Papouasie Nouvelle Guinée. Des épidémies ont également été signalées en régions tempérées, dont l’Italie en 2007, la France en 2010 et 2014, ainsi qu’en Afrique centrale et, plus récemment, au Brésil, dans l’état de Bahia.
Le génotype asiatique a émergé dans l’île de Saint-Martin (Antilles françaises en décembre 2013, avant de gagner les Amériques en 2014, causant plus de 2 millions de cas, et de diffuser en 2015 dans le Pacifique, en empruntant le chemin inverse de celui du virus Zika en 2014. À l’occasion de ces épidémies de grande ampleur, des formes graves de Cf jusque-là méconnues(1-9) et une transmission verticale périnatale materno-néonatale(2,8,9) ont été observées, ainsi que, parfois, une persistance inhabituelle de l’excrétion virale au-delà de la première semaine (3,10). Cet article confronte les résultats acquis lors des deux grandes vagues épidémiques dues à deux génotypes différents du virus.
Aspects virologiques et épidémiologie
Cycle viral du CHIK-v
Les Aedes sont des vecteurs diurnes qui piquent en début et en fin de journée, au pourtour et à l’intérieur des maisons. Lors de la piqûre, l’Aedes prélève le virus sur une personne infectée, puis le virus se multiplie dans son intestin avant de gagner ses glandes salivaires. Les Aedes infectent toute leur vie (3045 jours) et peuvent à l’occasion d’un autre repas sanguin transmettre le virus. Avec le recul, on sait désormais qu’il existe une capacité vectorielle différenciée, ECSA étant le mieux adapté à Ae. albopictus, le dernier virus asiatique en circulation, étant mieux propagé par Ae. aegypti.
Pathogénie
Les mécanismes de l’infection humaine à CHIK-v sont mieux compris. Une fois introduit dans l’organisme, après une réplication dans l’endothélium des capillaires sinusoïdes du foie, le virus gagne ses sites d’élection : les fibroblastes articulaires des muscles et de la peau où il est responsable d’arthralgies, de myalgies et d’exanthème.
L’aptitude du CHIK-v à disséminer dans l’organisme est inversement corrélée à l’âge et dépend directement de la capacité à secréter de l’interféron de type I. De fait, les nouveau-nés sont plus sensibles au neurotropisme du virus(6), ce qui a d’abord été observé dans l’Océan indien puis confirmé en Amérique. Les faits nouveaux sont l’isolement du virus à distance de la virémie, dans l’urine et le sperme(10), ainsi que dans le lait (article sous presse), sans que la contagiosité de ces fluides soit clairement démontrée.
Aspects cliniques et thérapeutiques
Présentation clinique commune chez l’enfant
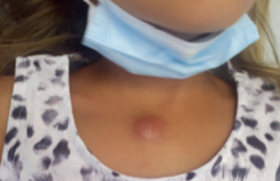
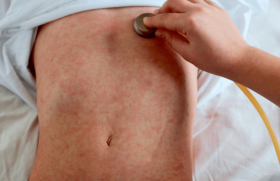
La présentation clinique est la même quel que soit le génotype et il n’y a toujours pas d’argument épidémiologique probant en faveur d’une virulence différente selon le génotype(11). Après une période d’incubation de 5 jours en moyenne, l’enfant présente une fièvre à 39-40°C, des myalgies, des arthralgies, un rash, plus rarement des signes digestifs. La rémission des symptômes est observée entre 3 et 4 jours. La convalescence est marquée par une asthénie. Chez les enfants ayant présenté une éruption, une hyperpigmentation est souvent notée(4). Les douleurs persistent parfois pendant des mois, rarement plusieurs années comme chez l’adulte.
Le traitement reste symptomatique. L’enfant garde le lit sous analgésiques et antipyrétiques (paracétamol : 60 à 80 mg/kg/j), et sous moustiquaire. L’hydratation reste prudente et elle doit compenser perte pour perte. L’aspirine est proscrite vue ses effets antiplaquettaires.
Formes cliniques pédiatriques
Les signes neurologiques, antérieurement rapportés en Asie et à la Réunion(3,6), ont été également observés en Amérique du Sud(7,8). Il s’agit d’une hypotonie, de convulsions au-delà de l’âge classique des convulsions fébriles, de troubles du comportement, d’un syndrome méningé ou de troubles de la conscience. L’encéphalite a été récemment définie avec des critères consensuels(6) et confirmée chez le nouveau-né(9). L’encéphalopathie des formes septiques est source d’irritabilité chez le petit nourrisson(7).
Les lésions vésiculo-bulleuses, initialement rapportées à la Réunion(4), ont été constatées chez un tiers des nourrissons de moins de 3 mois en Guyane(6). Dans cette population, la triade fièvreirritabilité-procalcitonine élevée avait un fort pouvoir discriminant pour distinguer les nourrissons infectés par le Chik-v de ceux présentant un sepsis d’autre origine(7).
Diagnostic positif
Diagnostic virologique
Le Chik-v est présent dans le sang des malades pendant la première semaine des symptômes où son génome peut être détecté par RT-PCR. Le niveau de virémie semble moindre avec le génotype asiatique d’après une étude expérimentale. Il est encore trop tôt pour conclure sur l’utilité des autres prélèvements (urines, sperme) à des fins diagnostiques.
Diagnostic sérologique
L’immuno-capture ELISA reste la méthode de choix pour détecter les IgM au-delà du 5e jour des symptômes. Les IgM persistent dans le sérum de convalescent en moyenne 18 mois. Les IgG apparaissent également vers le 14e jour en ELISA. Elles persisteraient à vie.
Prévention
Elle comporte des mesures de protection individuelle contre les piqures d’Ae., un isolement strict des malades en période de virémie pendant au moins 7 jours après le début des symptômes, enfin des mesures communautaires de lutte contre les Ae., consistant en la destruction des gîtes larvaires domestiques et péridomestiques. L’évaluation de candidats vaccins est en cours.
Conclusion
La Cf est une arbovirose dont l’aire de distribution géographique n’a cessé de croître et comporte désormais l’Amérique latine et le Pacifique. Sa connaissance est donc utile tant pour le conseil à l’enfant voyageur que pour le praticien en zone à risque épidémique ou devant traiter un enfant au retour d’une zone infestée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :