Publié le 16 jan 2011Lecture 10 min
Vers un vaccin contre le méningocoque B
J. GAUDELUS - Service de pédiatrie, CHU Jean-Verdier, Bondy, Université Paris 13
Les vaccins contre les méningocoques existent sous forme polysaccharidique (A ; A + C ; A, C, Y, W135) et/ou sous forme conjugué (C ; A, C, Y, W135) ; mais dans l’immédiat, et malgré une recherche très active, il n’existe pas de vaccin contre le méningocoque de sérogroupe B. Les résultats les plus récents laissent espérer ce vaccin dans un avenir proche.
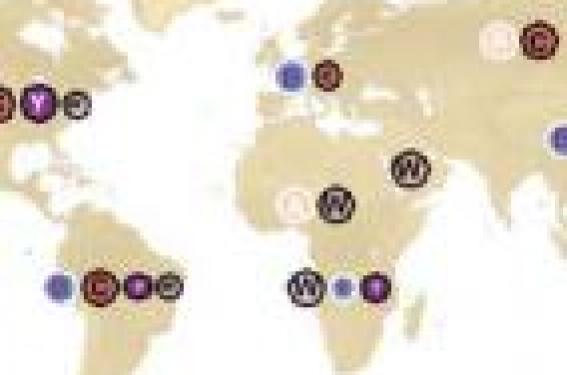
Épidémiologie L’épidémiologie des infections invasives à méningocoque varie en fonction des zones géographiques et dans le temps (figure 1). La zone qui a de loin l’incidence la plus élevée est la ceinture méningitique de la zone subsaharienne allant du Sénégal à l’Éthiopie. Durant les périodes épidémiques, l’incidence dans cette zone peut aller jusqu’à 1 % de la population. Le sérogroupe A est le sérogroupe le plus important dans cette région. En Amérique (nord et sud), l’incidence se situe entre 0,3 et 4 pour 100 000. Les sérotypes les plus représentés sont les sérotypes C et B, toutefois le sérogroupe Y représente un nombre important et le W135 est en augmentation. En Europe, l’incidence des infections invasives à méningocoque va de 0,4 à 14 pour 100 000, et la majorité de ces infections est due au sérogroupe B, en particulier dans les pays qui ont introduit le vaccin C conjugué. Le sérogroupe B prédomine également en Australie et en Nouvelle Zélande. En France, depuis plus de 20 ans, le taux d’incidence annuel des infections invasives à méningocoque (IIM) varie entre 1 et 2 pour 100 000. En 2009, il est de 1,1 pour 100 000 après correction du taux d’exhaustivité (estimé à 92 %). Parmi les IIM dont le sérogroupe était connu, 72 % étaient du sérogroupe B, 22 % du C, 3 % du W135 et 30 % du Y (figure 2). Figure 1. Distribution globale des sérogroupes de Neisseria menigitidis, d’après L.H. Harrison, Vaccine 2009 ; 275 : B51-B63. La proportion de Purpura fulminans rapportée pour les IIMB est stable depuis 2002 et était de 28,5 % en 2009. La létalité globale des IIM est de 23 % en présence d’un purpura fulminans et de 6 % en son absence. La létalité des IIMB et des IIMC était de 10 %(1). La construction des vaccins Particularités du méningocoque B Le méningocoque, Neisseria meningitidis, est une espèce bactérienne exclusivement retrouvée chez l’homme et sujette à de fréquentes variations génétiques par transformation et recombinaison. Des variants sont continuellement générés par mutation du fait d’échanges génétiques horizontaux entre les souches (2). Le mécanisme d’immunoprotection résulte de l’immunisation naturelle par des souches de portage et des réactions croisées avec des Neisseria commensales telles que N. lactamica. La capsule polyosidique de N. meningitidis est un facteur majeur de virulence, car elle permet l’échappement à la phagocytose primaire par les macrophages et à la lyse complément-dépendante. C’est à partir des antigènes polyosidiques capsulaires que sont fabriqués les vaccins contre les méningocoques de sérogroupe A, C, Y et W135. Il n’existe pas de vaccin polyosidique contre les méningocoques du sérogroupe B. La capsule du sérogroupe B ne détermine pas l’apparition d’anticorps bactéricides chez l’être humain. Quand ils existent, les anticorps générés sont avant tout de type IgM, non bactéricides et ne protègent pas. L’explication de cette faible immunogénicité est une parenté antigénique (homologie de structure) entre le polysaccharide B et certains tissus humains conduisant à une « tolérance » immunologique. Même lorsqu’il est conjugué à une protéine porteuse, ce polysaccharide reste peu immunogène. La capsule du sérogroupe B ne détermine pas d’apparition d’anticorps bactéricides chez l’être humain. Figure 2. Nombre de cas d’IIM par sérogroupes déclarés en France (données de la déclaration obligatoire de 1985 à 2008). L’absence de vaccin polyosidique contre les souches de sérogroupe B tente d’être contournée par le développement de vaccins à base de protéines de surface, mais la grande variabilité des immunogènes de surface est un obstacle à la généralisation de ce type de vaccin. Figure 3. Neisseria megingitidis, (CocciGram en diplocoques) (A) et vue des vésicules de membranes externes (OMV) (B). Cette difficulté a été partiellement surmontée par l’utilisation de vaccins fabriqués « sur mesure » (taylor made) à partir de vésicules membranaires (OMV pour outer membrane vesicle) exprimant l’ensemble des protéines de la membrane externe bactérienne (figure 3). Les vaccins préparés à partir de vésicules de la membrane externe ou vaccins OMV (3,4) Les vésicules sont semblables à des petites billes relarguées naturellement par le méningocoque pendant la culture et l’infection, et contiennent : des lipopolysaccharides, des protéines de la membrane externe, des protéines périplasmiques et des phospholipides. Les premiers vaccins fabriqués à partir de ces vésicules (fin des années 70, début des années 80) ont montré une augmentation de 4 fois ou plus de l’activité bactéricide du sérum chez 70 à 85 % des adultes après une dose unique, mais les enfants de moins de 6 ans avaient une réponse moindre. Plusieurs vaccins de ce type ont fait l’objet d’essais d’efficacité. • À Cuba, le premier vaccin de ce type, a eu une efficacité estimée de l’ordre de 80 % et deux études cas-contrôles effectuées au Brésil ont permis d’estimer l’efficacité chez l’enfant de 4 à 9 ans à 70- 74 %. Ces études ont suggéré que l’efficacité de ce type de vaccin était restreinte à la souche qui était à l’origine du vaccin. • En Norvège, un vaccin préparé à partir d’une souche épidémique a montré une efficacité de 57 % après 2 doses, mais une diminution de cette efficacité avec le temps : 87 % dans les 10 premiers mois, mais seulement 30 % après 21-29 mois. Lorsque l’on fait des doses additionnelles, on obtient une augmentation du titre des anticorps bactéricides et une efficacité élargie à d’autres sous-types. Ce vaccin est utilisé en France pour tenter de contrôler l’épidémie normande due à une souche voisine de méningocoque de sérogroupe B. • En Nouvelle Zélande, après 3 doses d’un vaccin OMV préparé à partir de la souche épidémique, une augmentation de l’activité bactéricide du sérum d’un facteur 4 a été montrée chez 53 % des enfants de 6-8 semaines, 74-76 % des 6 mois-12 ans et 96 % des adultes. Là encore, il a été constaté une perte d’immunité avec le temps. Ce vaccin a été généralisé en 2004 (début de l’épidémie en 1991 et pic en 2001) et a contribué à la diminution du nombre de cas. Son efficacité sur le terrain a été évaluée à 70-80 %. Les anticorps bactéricides induits par le vaccin sont très spécifiques du séro-sous-type et dirigés avant tout contre la porine A, mais il y a plus de 600 variants de porine A (même si peu d’entre elles ont été associées aux isolats responsables de la maladie). Pour tenter d’élargir la couverture vaccinale, un vaccin contenant six porine A de membrane de vésicule externe a été développé aux Pays-Bas, lesquelles couvrent environ 60 à 70 % des isolats de méningocoque responsables d’infection invasive en Europe. Un vaccin nonavalent (9 Por A) fait passer ce chiffre à 70-80 %. Pour tenter d’élargir la protection, on a essayé de combiner les vésicules de membranes externes et ces derniers vaccins. Chez les adolescents et les adultes, 42 à 87 % ont des anticorps bactéricides visà- vis des souches homologues (exprimant la même Por A). Il semble essentiel qu’il y ait à la surface de la bactérie des anticorps bactéricides en quantité suffisante pour médier la bactériolyse. Ces anticorps peuvent être induits par une protéine majeure comme la Por A ou par de multiples protéines mineures de la membrane externe. Il reste à résoudre cependant, d’une part, le problème de la réponse très restreinte et, d’autre part, l’absence de réponse immunitaire persistante suggérant que des doses multiples seront nécessaires pour maintenir la protection. Les vaccins candidats les plus à même d’être mis sur le marché dans un avenir proche (5,6) Le cahier des charges de ces vaccins est d’induire la formation d’anticorps vis-à-vis de protéines immunogènes situées à la surface du méningocoque qui soient bactéricides. Ces protéines doivent être très conservées chez les méningocoques et, si possible, présenter des variations minimes. Deux vaccins recombinant sont en cours de développement. ● Le vaccin développé par Novartis Ce vaccin a été développé à partir de la « reverse vaccinology ». Celle-ci consiste à identifier des protéines candidates exposées à la surface de la bactérie à partir du génome de N. meningitidis. Ces protéines purifiées sont ensuite utilisées pour immuniser la souris. Celles qui induisent des anticorps bactéricides ont été sélectionnées et les plus immunogènes d’entre elles ont été incluses dans le vaccin. Il contient 3 protéines : NadA, fHbp (factor H binding protein : protéine porteuse du facteur H [ou GNA 1870 ou LP 2086], NHBA [Neisserial heparin binding antigen] ou GNA 2132) combinées avec le vaccin OMV de Nouvelle Zélande. Les sérums issus des souris immunisées (sans l’OMV de Nouvelle Zélande) tuent 66 des 85 isolats (78 %) représentant les souches circulant dans le monde. Si on y inclut l’OMVNZ, dans une étude de phase II, l’administration de 3 doses détermine l’apparition d’une activité bactéricide du sérum d’un quart ou plus chez 63 à 100 % des jeunes enfants et 96 à 100 % des enfants de 6 à 8 mois vis-à-vis des souches homologues. Les gènes codant fHbp et NHBA sont présents dans tous les méningocoques, alors que seulement 38 à 46 % contiennent NadA. Un des problèmes potentiels visà- vis de ces protéines de membranes externes utilisées comme composant de vaccins est la variation de leur expression entre les souches. Les protéines de surface immunodominante de type Por A qui sont exposées au système immunitaire in vivo sont sous pression de sélection immunologique (et peuvent montrer une variabilité de séquence). La conservation de NadA, fHbp et NHBA suggère qu’elles ne sont pas naturellement immunologiquement exposées (et seraient ainsi moins sujettes à variation). ● Le vaccin développé par Pfizer (Wyeth) Il utilise le fHbp ou protéine de liaison du facteur H et du complément humain. C’est une lipo-protéine de membrane externe, responsable du recrutement du facteur H à la surface de la bactérie, ce qui aboutit à une dysrégulation de la voie du complément et donc à une augmentation de la survie de la bactérie. Les anticorps anti-fHbp peuvent avoir des effets bénéfiques par de multiples mécanismes. L’inhibition du transport du facteur H augmente la susceptibilité de la bactérie à être tuée par la voie alterne du complément et induit une activité bactéricide directe par la voie classique. Le gène (LP 2086) est présent dans tous les isolats cliniques testés du méningocoque B. Il existe deux sous-familles (A et B) de fHbp. Ces deux sous-familles sont présentes dans le vaccin candidat. ● D’autres vaccins sont à l’étude utilisant d’autres protéines (FetA, LbpA et LbpB), protéines régulées par le fer ou encore le lipopolysaccharide impliqué dans la réponse immune de l’infection naturelle. Les progrès des connaissances sur le méningocoque B, l’utilisation de techniques comme la reverse vaccinology ont permis de nouvelles approches dans la construction de nouveaux vaccins. La variabilité génétique et antigénique des méningocoques de sérogroupe B constitue un véritable défi à la mise au point d’un vaccin universel. Deux candidats vaccins seront très vraisemblablement mis sur le marché dans un délai proche. Seules les études après commercialisation permettront d’apprécier leur efficacité réelle.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :