Publié le 24 mai 2024Lecture 8 min
La relation de soin au cœur du congrès de la SFNP
Benjamin SERRAND, CHU de Rennes
Rennes a accueilli les neuropédiatres français du 24 au 26 janvier 2024 pour la 33e édition du congrès de la Société française de neurologie pédiatrie (SFNP). Benjamin Serrand (CHU de Rennes), l’un des deux présidents du comité local d’organisation, a choisi quelques communications marquantes pour Pédiatrie Pratique.
La chorée chez l’enfant
• D’après la présentation de Claudia Ravelli, Hôpital Trousseau (Paris), « Chorée en neuropédiatrie : démarche diagnostique et thérapeutique, apports de la génétique en 2024 »
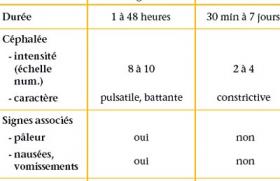
La chorée est un mouvement anormal, involontaire, hyperkinétique, subcontinu, irrégulier et brusque touchant les membres et/ou le tronc et la face, et associée à une hypotonie. Sur le plan physiopathologique, la chorée est la conséquence d’une dysfonction striatale en lien avec une lésion structurelle ou fonctionnelle des neurones épineux moyens.
La première étape de la démarche diagnostique est la reconnaissance sémiologique de la chorée, car les recherches étiologiques diffèrent de celles des diagnostics différentiels (ataxie cérébelleuse, myoclonies, etc.).
L’interrogatoire doit faire préciser les antécédents du patient, l’histoire de la chorée (début, évolution, facteur déclenchant), le côté unilatéral ou, au contraire, le caractère généralisé, et rechercher des symptômes associés, neurologiques et extraneurologiques.
Une IRM cérébrale, un bilan biologique comprenant NFS, glycémie, ionogramme, Ac ASLO/antistreptodornase, CRP-VS, bilan thyroïdien, bilan phosphocalcique, ainsi qu’une ponction lombaire sont à réaliser en première intention.
Deux grands cadres diagnostiques sont à distinguer. Un début aigu/subaigu qui oriente vers les origines acquises alors qu’un début précoce dans la petite enfance avec une évolution chronique oriente vers des étiologies génétiques ou en lien avec des séquelles périnatales (anoxoischémie, ictère néonatal).
• Dans les chorées aiguës, il faut rechercher : une cause médicamenteuse (valproate, dopamine), une infection à streptocoque orientant vers une chorée de Sydenham qui nécessite un traitement antibiotique au long cours ; des arguments en faveur d’une encéphalite (encéphalite à Ac antiNMDA) ; une origine mitochondriale ; une décompensation de maladie métabolique sous-jacente (déficit en GLUT-1, déficit en sulfite oxydase) ; un neurolupus ou une encéphalite infectieuse (EBV, HSV, etc.) ; une origine vasculaire, notamment en cas de chorée unilatérale.
• Pour les chorées chroniques, l’imagerie cérébrale peut orienter vers un ictère nucléaire même si les anomalies radiologiques sont parfois discrètes. La cause génétique la plus fréquente représentant près de la moitié des cas, est liée au gène NKX2-1, et était auparavant appelée : chorée héréditaire bénigne. Même si une amélioration est souvent constatée avec les années, son caractère bénin est remis en cause. Des atteintes pulmonaires et thyroïdiennes sont à rechercher chez les enfants porteurs de cette mutation. Récemment, les techniques de séquençage de nouvelle génération ont permis la découverte de nouveaux gènes impliqués dans la chorée. Certains sont à connaître car une prise en charge spécifique est recommandée comme la caféine dans les mutations du ADCY5.
La prise en charge est néanmoins le plus souvent symptomatique, médicamenteuse, rééducative (kinésithérapie, ergothérapie) ou par le biais de la stimulation cérébrale profonde dans les cas les plus sévères.
Raisonnement devant une hypotonie néonatale
• D’après la présentation de Cyril Gitiaux, hôpital Necker-enfants malades (Paris), « Bébé hypotonique : apports des examens complémentaires pour les étiologies périphériques »
Une hypotonie néonatale est une diminution du tonus, mise en évidence dans le premier mois de vie. Elle ne préjuge pas de la cause : diminution de la force, hyperlaxité, hypomobilité fœtale/arthrogrypose ou atteinte de la commande centrale. Les étiologies centrales sont à l’origine de deux tiers des hypotonies néonatales, tandis que les causes périphériques (myotonie congénitale, syndrome myasthénique, neuropathie, atteinte de la corne antérieure) n’en représentent qu’un tiers.
Comme dans toute démarche diagnostique, il faut une anamnèse précise. L’interrogatoire s’efforcera notamment de spécifier les antécédents familiaux (myotonie chez les parents), l’histoire de la grossesse (les mouvements actifs fœtaux, la quantité de liquide amniotique) et le contexte de naissance (le travail, la présentation, l’adaptation à la vie extra-utérine avec le score d’Apgar). La cinétique d’évolution des symptômes est également indispensable : présence d’un intervalle libre, dégradation progressive, amélioration spontanée.
Ensuite, l’examen clinique occupe évidemment une place centrale. Certains éléments permettent de s’orienter vers une étiologie centrale ou périphérique :
- symptômes évoquant une étiologie centrale : hypotonie surtout axiale, dysmorphie, force préservée au niveau des membres, réflexes ostéotendineux présents, voire vifs, interactions pathologiques, épilepsie, irritabilité, micro/macrocéphalie ;
- symptômes orientant vers une étiologie périphérique : force diminuée de manière globale, périmètre crânien normal, fasciculations linguales, réflexes ostéotendineux absents, motricité faciale anormale (hypomimie, troubles de l’oculomotricité, cris faibles), avec interactions préservées.
En cas d’orientation vers une étiologie centrale, une IRM cérébrale, un bilan métabolique et un EEG sont à réaliser. En cas d’orientation vers une étiologie périphérique, un dosage des CPK, de la maltase acide (notamment en cas d’anomalie cardiaque) et la recherche d’anticorps antiRach chez la maman sont à réaliser. Un électroneuromyogramme (ENMG) et une biopsie musculaire doivent être discutés en cas de forte suspicion d’atteinte périphérique. Sur le plan génétique, 3 maladies génétiques sont recherchées spécifiquement dans cette situation (Prader-Willi avec une étude la méthylation, amyotrophie spinale infantile, Steinert congénital avec la recherche d’une expansion anormale de triplets). Depuis quelques années, l’exome néonatal est souvent réalisé.
La place des examens complémentaires est aujourd’hui questionnée avec l’avènement du séquençage rapide. Le génome est parfois l’examen de première intention aux États-Unis dans cette situation et les examens complémentaires radiologiques, biologiques ou électrophysiologiques sont en seconde ligne pour confirmer ou infirmer un résultat génétique. La place du raisonnement clinique demeure essentielle pour ne pas méconnaître une cause urgente traitable, guider les examens complémentaires et étayer un résultat génétique.
Soutien à la parentalité
• D’après la conférence d’Anne Raynaud, « Comment soutenir les familles dans un contexte de maladie ou d’hospitalisation »
Être parent en 2024 est parfois difficilement vécu. En effet, le culte de la performance, la pression excessive, les injonctions paradoxales, les modèles scientifiques parfois opposés rendent souvent inintelligibles les conseils sur la parentalité. Le risque est également de fragiliser la confiance parentale par un excès de recommandations qui viendrait percuter leurs fonctionnements. Il est donc nécessaire d’inverser le paradigme et de partir des besoins de l’enfant pour les guider vers une parentalité harmonieuse. Ainsi, il est indispensable de connaître les besoins fondamentaux de l’enfant pour les accompagner au mieux en tant que parents.
Cinq besoins fondamentaux ont été identifiés chez l’enfant : ceux de sécurité, d’exploration, de cadre et de limites, d’identité et d’estime de soi. Le besoin de sécurité est défini comme un métabesoin, il surplombe et conditionne les autres. La sécurité englobe le besoin affectif et relationnel, la nécessité de protection et les impératifs physiologiques et de santé. La théorie de l’attachement est intimement liée à ce métabesoin de sécurité. L’attachement n’est pas l’amour ; il est nécessaire et activé en cas de menace pour réguler la peur. La figure d’attachement est une personne vers laquelle l’enfant peut se tourner en cas de détresse pour avoir protection et réconfort. L’enfant a alors besoin de prévisibilité, de disponibilité, de sécurité pour construire ses liens d’attachement. L’exploration est indispensable dans le développement de l’enfant, mais entre en compétition avec l’attachement. En cas de menace, le système d’attachement se met en activité et diminue les capacités d’exploration.
En cas d’attachement sécure, l’enfant explore et sait trouver refuge en cas de détresse auprès de sa figure d’attachement. Cela lui permet de renouveler ses expériences d’exploration et donc de se développer et de se construire une identité. En cas d’attachement insécure évitant, cette figure est insuffisamment disponible ce qui va limiter l’enfant dans son exploration et peut entraîner sa mise en retrait. En cas d’attachement insécure ambivalent, l’enfant ne sait pas si cette figure est disponible et peut envoyer des signaux contradictoires (agitation, opposition). Enfin, l’attachement désorganisé avec une figure d’attachement effrayante est une situation dans laquelle l’enfant ne sait pas comment faire pour que l’on réponde à ses besoins.
La connaissance de ces concepts peut aider le pédiatre dans son rôle de guidance parentale.
Point d’étape sur le dépistage néonatal de l’amyotrophie spinale infantile
• D’après la présentation de Vincent Laugel, CHU de Strasbourg
L'amyotrophie spinale infantile (ASI) est une pathologie du motoneurone, dont la forme de révélation précoce, appelée ASI de type I, conduisait inexorablement à un décès rapide des enfants qui en étaient atteints. Dans 95 % des cas, il s’agit d’une maladie autosomique récessive liée à des délétions de l’exon 7 du gène SMN1 (survival motoneurone 1). Il existe depuis quelques années, 3 traitements qui ont radicalement modifié le pronostic de cette maladie. D’une part, deux molécules qui modulent l’épissage du gène SMN2 et permettent ainsi une synthèse plus importante de la protéine déficiente SMN et, d’autre part, une thérapie génique. Cependant, la réponse au traitement est corrélée à la précocité de l’administration. Les enfants traités en présymptomatique ont souvent un développement moteur proche de la normale.
Dans ce cadre, de nombreux pays développent un dépistage néonatal. En France, un programme pilote appelé Dépisma est en cours dans deux régions dans un format de recherche clinique : Nouvelle Aquitaine et Grand-Est. Avec 1 an de recul, le taux d’exhaustivité est de 93 % avec près de 60 000 screenings néonataux réalisés dans 99,5 % des maternités de ces deux régions. Il n’y a pas eu de faux négatif ni de faux positif. Le taux d’acceptation des parents est de 98 %. En 1 an, 5 diagnostics ont été réalisés avec 4 traitements avant l’âge de 1 mois.
Les résultats ont été obtenus en 7 jours en moyenne avec un traitement au 23e jour.
La généralisation à la France entière est souhaitable dans les meilleurs délais pour administrer ces thérapies innovantes au plus tôt, en présymptomatique pour une meilleure efficacité, et ainsi donner toutes les chances aux enfants atteints d’amyotrophie spinale infantile.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :