Publié le 25 mar 2024Lecture 6 min
Des vomissements particulièrement incoercibles
Sarah BAMBERGER, Centre hospitalier de Saint-Denis
La rubrique « En direct des staffs » est ouverte à tout médecin d’un service de pédiatrie souhaitant partager avec les lecteurs de Pédiatrie Pratique les cas discutés dans son service et qu’il estime suffisamment intéressants et édifiants pour être portés à la connaissance de ses confrères.
lI s’agit d’une jeune fille de 13 ans et 7 mois ayant initialement consulté pour un tableau de fièvre prolongée. Elle ne présente pas d’antécédent familial ou personnel notable.
Elle a été hospitalisée pour une fièvre évoluant depuis 10 jours associée à des gonalgies bilatérales, des vertiges et une perte de 3 kg en 10 jours. L’examen clinique met en évidence un œdème non inflammatoire du genou droit ; le reste de l’examen est sans particularité. Le bilan biologique a permis d’éliminer une infection bactérienne : CRP négative, bandelette urinaire négative, radiographie du thorax normale, hémoculture négative. Les sérologies virales étaient en faveur d’une immunité ancienne pour CMV et EBV. Les bilans clinique et biologique ne révèlent pas d’argument en faveur d’une cause tumorale : pas de syndrome tumoral clinique, NFS normale, frottis sanguin normal. Sur le plan auto-inflammatoire, la VS est à 45, les anticorps antinucléaires sont faiblement positifs à 1/320. Vingt-quatre heures après le début de l’hospitalisation, la patiente est spontanément apyrétique et le retour à domicile est autorisé.
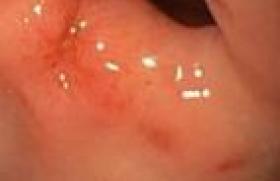
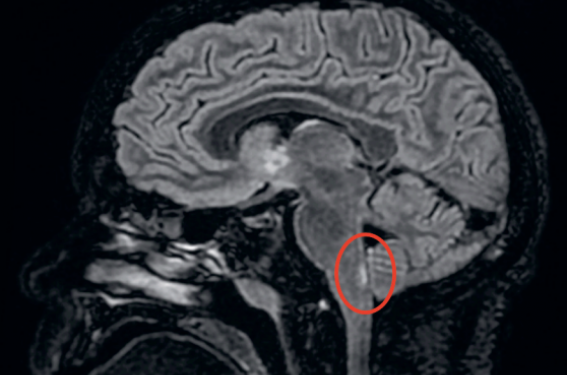
Trois jours après sa sortie, elle consulte de nouveau pour un tableau de vomissements incoercibles, avec douleur épigastrique majeure sans diarrhée ni fièvre associée. On constate une perte de poids de 3 kg en 3 jours. Le bilan biologique met en évidence des stigmates d’hémoconcentration, une lipase normale, un bilan hépatique normal. L’échographie abdominale est également normale. Lors de l’hospitalisation, les vomissements persistent malgré une hydratation intraveineuse, un repos digestif et l’administration d’ondansétron. Un traitement antalgique par nalbuphine est nécessaire. Après 24 heures d’hospitalisation, une hématémèse de moyenne abondance apparaît, sans déglobulisation. L’endoscopie œsogastroduodénale montre un aspect d’œsophagite érosive du tiers inférieur (figure 1), ainsi que des érosions antrales d’allure mécanique (figure 2). Les vomissements ont persisté malgré l’ajout d’un inhibiteur de la pompe à protons en IV. Finalement, une IRM cérébrale est réalisée 48 heures après le début de l’hospitalisation. Elle met en évidence une lésion de la moelle allongée décrite comme : « une anomalie de signal punctiforme et pseudo-nodulaire périaque ducale, pontique et temporale droite, le tout faisant évoquer en premier lieu une origine infectieuse, une atteinte démyélinisante ne pouvant toutefois ne pas être écartée » (figure 3).
Figure 1. Endoscopie œsogastroduodénale retrouvant une œsophagite érosive un tiers inférieur.
Figure 2. Endoscopie œsogastroduodénale retrouvant des érosions antrales d’allure mécanique.
Figure 3. IRM cérébrale, coupes sagittales, hypersignal area postrema et lobe temporal.
Devant ces anomalies de signal du tronc cérébral, la patiente est transférée en neurologie pour bilan de rhomboencéphalite. L’analyse de l’IRM cérébrale a permis de localiser les anomalies de signal, notamment à la zone de l’area postrema, évoquant le diagnostic de maladie du spectre de la neuromyélite optique (NMO). Le tableau clinique initial a probablement joué le rôle de « trigger » infectieux. Ce diagnostic a pu être confirmé par la positivité des anticorps antiaquaporine 4. Le bilan d’extension a inclus un fond d’œil et une IRM médullaire, tous deux normaux. Les symptômes se sont rapidement amendés après administration de bolus de corticoïdes, puis un traitement au long cours par rituximab est débuté.
Discussion
L’area postrema est une structure localisée à la jonction du tronc cérébral et de la moelle, au niveau du plancher dorsal du 4e ventricule médullaire (figure 4). C’est une structure circumventriculaire polymorphe et neuroendocrinienne. Cette zone est très vascularisée et riche en aquaporine 4.
Figure 4. L’area postrema est une structure localisée à la jonction du tronc cérébral et de la moelle, au niveau du plancher dorsal du 4e ventricule médullaire.
D’après Chan KH, Vorobeychik G. BMJ Case Rep 2020.
L’area postrema est le centre de régulation des nausées/vomissements mais est également impliquée dans le contrôle des manifestations vasomotrices, la régulation de la sensation de faim et la régulation du poids. C’est, par exemple, elle qui est responsable des nausées/vomissements à la fin du 1er trimestre de grossesse.
L’atteinte de l’area postrema (syndrome de l’area postrema) est à l’origine de symptômes d’allure digestive faisant souvent errer le diagnostic. Le tableau clinique est celui de nausées,vomissements incoercibles, éructations incontrôlables ; survenant de façon brutale et durant plus de 48 heures. Ces symptômes sont constants ou intermittents et ne répondent pas aux traitements symptomatiques habituels. Puis leur résolution est le plus souvent totale.
Cette entité est un des 6 tableaux cliniques typiques pouvant révéler une maladie du spectre de la neuromyélite optique (NMO). Les maladies du spectre de la NMO sont un groupe de pathologies auto-immunes rares, touchant particulièrement le nerf optique et la moelle épinière. La prévalence de la NMO est de 1 à 4/100 000 adultes, avec une prédominance chez la femme (ratio de 7/1). Chez l’enfant, l’âge moyen au diagnostic est de 11,9 ans et le sexe ratio est de 3 filles pour 1 garçon.
Les tableaux cliniques faisant suspecter une maladie du spectre de la NMO sont : la névrite optique, la myélite aiguë, le syndrome de l’area postrema, les autres atteintes du tronc cérébral, l’atteinte diencéphalique, l’atteinte d’un hémisphère cérébral (tableau).
Depuis 2005, il a été décrit que la plupart des patients (70-80 %) présentant une maladie du spectre de la NMO ont des IgG dirigées contre l’aquaporine 4. Ainsi, la présence d’anticorps antiaquaporine 4 associés à un tableau clinique typique est suffisant pour affirmer le diagnostic. En cas de négativité des anticorps, il faudra 2 tableaux cliniques évocateurs et une imagerie cérébrale compatible.
Le syndrome de l’area postrema est la 3e présentation clinique la plus fréquente, bien qu’elle reste largement méconnue. Environ 30 % des patients vont présenter une atteinte de l’area postrema, aussi bien de façon inaugurale, qu’au cours de leur maladie. Chez l’enfant, 16 % des patients présentent un syndrome de l’area postrema inaugural. Il est crucial d’identifier ce diagnostic afin de prévenir le risque de poussée future. De plus, l’area postrema se situant en continuité avec la région bulbaire et la moelle cervicale, il existe un risque d’extension vers ces zones et de symptômes hautement invalidants, voire mettant en jeu le pronostic vital.
Conclusion
Le syndrome de l’area postrema est une entité clinique bien décrite, mais méconnue, devant faire évoquer une maladie du spectre de la NMO. C’est la 3e expression clinique la plus fréquente de la maladie. Son tableau purement digestif induit un retard diagnostique, alors même qu’il est primordial d’identifier la pathologie car un traitement rapide permet de limiter le risque d’extension des lésions, pouvant engager le pronostic vital du fait de leur localisation.
Pour en savoir plus :
• Flanagan EP et al. Short myelitis lesions in aquaporin-4-IgG–positive neuromyelitis optica spectrum disorders. JAMA neurology 2015 ; 72(1) : 81-7.
• Sarnat HB, Flores-Sarnat L, Boltshauser E. Area postrema: fetal maturation, tumors, vomiting center, growth, role in neuromyelitis optica. Pediatric neurology 2019 ; 94 : 21-31.
• Raj A, Valappil AV, Alapatt PJ, Kamar J. Area postrema syndrome: An unusual presentation of neuromyelitis optica spectrum disorder. J Neurosci Rural Pract 2023 ; 14(2) : 361-2.
• Wingerchuk DM et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015 ; 85(2) : 177-89.
• PNDS. Les maladies du spectre de la neuromyélite optique. Mars 2021
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :