Publié le 28 nov 2022Lecture 16 min
La fibroscopie en ORL pédiatrique
Romain LUSCAN, Paris, Nicolas LEBOULANGER, Paris, Natacha TEISSIER, Paris*
-
Qu’est-ce qu’une nasofibroscopie ?
La nasofibroscopie est un élément d’examen clinique qui permet d’explorer rapidement une grande partie de la sphère ORL. Elle est d’une aide précieuse en ORL pédiatrique.
Condition de l’examen
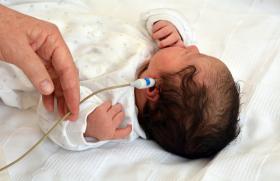
La fibroscopie est un examen simple et non invasif. Elle peut être réalisée en consultation ou au lit du patient (notamment en réanimation, chez un enfant non déplaçable). L’enfant est éveillé au moment de l’examen. Il existe différents diamètres de fibroscopes afin de s’adapter au mieux à l’âge et à l’anatomie de l’enfant. Le fibroscope est inséré dans le nez (la plupart du temps) ou dans la bouche de l’enfant (jusqu’à 2-3 mois de vie maximum) en fonction de son âge et de la pathologie recherchée (figure 1). Une anesthésie locale n’est pas recommandée(1,2).
• Régions explorées grâce à la fibroscopie
La nasofibroscopie permet l’examen d’une grande partie de la sphère ORL. L’examen commence par l’inspection des fosses nasales, puis du cavum. Il se poursuit par l’examen de l’oropharynx, du larynx et enfin de l’hypopharynx. Le tiers supérieur de l’œsophage peut également être examiné. Comme il s’agit d’un examen vigil, la mobilité des cordes vocales est évaluée, ainsi que le tonus global du tractus aérodigestif. Enfin, en fonction des équipes et sous couvert d’un milieu de réanimation ou d’une anesthésie générale au bloc opératoire, la région sous-glottique, la trachée et les bronches peuvent également être explorées.
• Indications
On pourrait dire que tout examen ORL pédiatrique bien conduit doit comporter une nasofibroscopie. Les principales indications sont les suivantes :
– obstruction nasale chronique ;
– rhinorrhée chronique ;
– épistaxis ;
– syndrome d’apnée obstructif du sommeil (SAOS) ;
– dyspnée inspiratoire ;
– stridor ;
– cornage ;
– fausses routes.
Principales pathologies nasales
Toute suspicion de pathologie nasale ou sinusienne, quel que soit l’âge de l’enfant, doit entraîner la réalisation d’une fibroscopie par voie nasale. Les principales pathologies rencontrées sont les suivantes(3).
• Enfants de moins de 6 mois : pathologies malformatives
• La rhinite néonatale
Sa physiologie est mal connue. Elle se manifeste par une simple gêne, au minimum, ou par une détresse respiratoire importante. La fibroscopie est souvent difficile, montrant une muqueuse inflammatoire et des cornets inférieurs volumineux. Elle se traite essentiellement par des soins locaux (lavages de nez au sérum physiologique isotonique, voire hypertonique ou adrénaliné dans les cas les plus sévères).
• La sténose congénitale des orifices piriformes
Elle est souvent associée à d’autres malformations de la ligne médiane. L’orifice antérieur osseux des fosses nasales est souvent très rétréci, empêchant jusqu’au passage du fibroscope pédiatrique, ce qui est très en faveur du diagnostic ! Elle se traite également par des soins locaux et souvent par un élargissement chirurgical de cet orifice osseux, éventuellement associé à une turbinoplastie inférieure afin de dégager un maximum les fosses nasales.
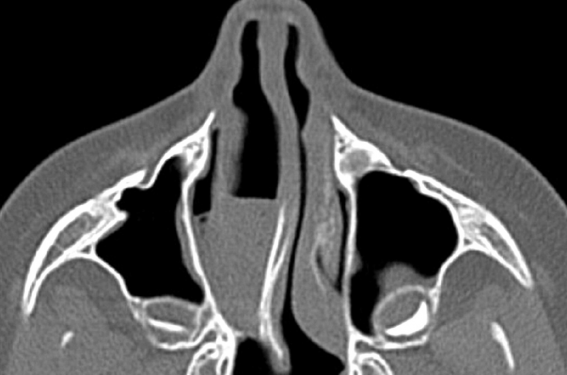
• L’atrésie choanale
C’est une fermeture complète de la choane, orifice postérieur des fosses nasales donnant sur le cavum. Il n’y a jamais d’hypoplasie choanale, la fermeture étant complète (figure 2). En cas d’atrésie unilatérale, la tolérance est souvent bonne et la découverte de l’anomalie peut être tardive, devant une narine complètement obstruée en permanence. En cas d’atrésie bilatérale, en revanche, un nouveau-né ne respirant que par le nez, la détresse respiratoire est immédiate rendant nécessaire la mise en place en salle de naissance d’une canule de Mayo-Guédel, voire d’une sonde d’intubation. Le traitement est chirurgical, par voie endonasale, et consiste en la reperméabilisation de la choane. L’intervention a lieu dans les premiers jours après la naissance dans le cas d’une malformation bilatérale, et plutôt à partir de 18 mois de vie dans les atteintes unilatérales. Enfin, un bilan malformatif est nécessaire afin d’éliminer notamment une séquence CHARGE. À ce titre, un scanner du massif facial et une échographie cardiaque seront systématiquement réalisés avant tout geste chirurgical.
• Les méningocèles
Les méningocèles et méningoencéphalocèles sont la présence anormale de tissu méningé dans les fosses nasales suite à une déhiscence du toit de ces dernières, au niveau de l’ethmoïde. Ces hernies de tissu méningé pouvant contenir du tissu encéphalique peuvent être à l’origine de fuite nasale de liquide céphalorachidien, de méningites, ou moins sévèrement d’une obstruction nasale lentement progressive. La pression cérébrale tend en effet à faire augmenter la lésion de volume au cours du temps. En fibroscopie, l’aspect est d’emblée très évocateur : une lésion rosée, homogène, non saignante, qui peut être battante et dont l’origine se situe en hauteur, en dedans du cornet moyen. C’est alors l’imagerie qui confirmera le diagnostic et le traitement est dans la plupart des cas endoscopique, consistant en la réduction du sac herniaire et la reconstruction du toit de la fosse nasale.
• Chez l’enfant plus âgé
• L’hypertrophie des végétations adénoïdes
C’est la cause la plus fréquente de l’obstruction nasale chez le jeune enfant. La nasofibroscopie permet de bien visualiser le paquet adénoïdien et de quantifier le degré d’obstruction. Sa réalisation est indispensable avant d’envisager un geste opératoire.
• Les pathologies infectieuses et inflammatoires
Rhinites, rhinosinusites, sinusites aiguës ou subaiguës, polyposes, les pathologies infectieuses ou inflammatoires possibles sont nombreuses. La nasofibroscopie permet dans tous les cas une orientation étiologique fondamentale, ainsi qu’une localisation spatiale dans les cas d’infection localisée (sinusite maxillaire, ethmoïdale, frontale, sphénoïdale). • Les pathologies tumorales Enfin, à tout âge, des pathologies tumorales sont possibles : congénitales (tératomes), bénignes (polype de Killian, angiofibrome, etc.) ou malignes (rhabdomyosarcome, carcinome indifférencié du cavum, etc.). Dans la plupart des cas, la nasofibroscopie donne d’importants éléments cliniques qui peuvent orienter vers telle ou telle étiologie. En fonction des cas, le diagnostic sera confirmé par l’imagerie et/ou l’anatomopathologie.
Principales pathologies laryngées
• Chez l’enfant de moins de 6 mois
• Laryngomalacie
Il s’agit de la première cause de stridor chez le nouveau-né. Elle est aussi appelée stridor laryngé congénital essentiel. La laryngomalacie se caractérise par un bruit inspiratoire, polyphasique, de tonalité aiguë, sans modification du cri ni de la voix. Ce bruit apparaît habituellement dans les dix premiers jours de vie. À la fibroscopie, on met en évidence un collapsus inspiratoire des structures supra-glottiques (figure 3) ; les replis aryépiglottiques sont courts, associés à une bascule antérieure des massifs aryténoïdiens et postérieure de l’épiglotte. L’épiglotte peut parfois même être tubulisée, en forme d’oméga (Ω). Du fait de l’aspiration de ces différentes structures à l’inspiration, les cordes vocales peuvent être difficilement visibles. Parfois, l’épiglotte peut traverser le plan glottique (c’est-à-dire passer entre les cordes vocales) et majorer le blocage inspiratoire, d’autant plus marqué que l’enfant respire rapidement, par exemple, aux pleurs ou lors de l’alimentation.
Enfin, la fibroscopie peut mettre en évidence des signes indirects de reflux, fréquemment associé, par l’existence d’un œdème ou d’un érythème des structures laryngées. Dans plus de 90% des cas, la laryngomalacie est bénigne. Une surveillance clinique et la mise en place d’un traitement symptomatique suffisent. Les cas restants sont considérés comme sévères, et seulement quelques cas nécessitent une prise en charge chirurgicale. La sévérité se définie par un retard de croissance pondérale, une difficulté à la prise des biberons, des épisodes de dyspnée, l’apparition d’un tirage intercostal et xiphoïdien, voire des épisodes de détresse respiratoire ou de cyanose. Enfin, il peut exister des apnées obstructives au sommeil. Selon les recommandations de la SFORL de 2011, la prise en charge passe d’abord par un traitement médical qui comporte l’épaississement des biberons, la station proclive et la mise en place d’un traitement anti reflux acide (anti-H2 ou inhibiteurs de la pompe à protons) (figure 4). Si le nourrisson présente des signes de gravité, une section ou résection des replis aryépiglottique sera proposée : ceci permettra d’ouvrir la région supraglottique du larynx et ainsi faire disparaître le collapsus. Ce geste peut être couplé à un geste épiglottique : une section partielle ou une pexie permettant de limiter la bascule de cette structure sur le plan glottique. L’amélioration de la symptomatologie est alors souvent rapide après le geste, au maximum dans les 5 premières semaines, alors que l’évolution naturelle de la maladie n’est favorable en moyenne qu’en 29 semaines(4); 94% des enfants opérés sont améliorés, 71% sont guéris(5). Il peut persister un stridor sans conséquences cliniques. Les échecs se caractérisent par la persistance de difficultés respiratoires alimentaires. Ils sont d’autant plus fréquents que l’enfant est jeune lors de sa première chirurgie et qu’il existe des comorbidités, notamment cardiaques ou neurologiques. En cas de contre-indications à la chirurgie ou un tableau atypique de laryngomalacie neurologique, ou encore en première intention, la ventilation non invasive peut améliorer la tolérance de la laryngomalacie chez le nourrisson(6). Exceptionnellement, on peut recourir à une trachéotomie chez des enfants non opérables et ne tolérant pas la ventilation non invasive (VNI).
• Kyste de la vallécule
L’un des diagnostics différentiels de la laryngomalacie est le kyste de la vallécule. Il s’agit d’un kyste au contenu mucoïde développé au niveau de la base de langue. Il entraîne une bascule postérieure de l’épiglotte, qui de ce fait vient fermer le plan glottique tel un clapet (figure 3). Cliniquement, il se présente comme un stridor associé à une dyspnée inspiratoire avec une difficulté à la prise des biberons chez un nouveau-né. La fibroscopie permet de confirmer le diagnostic et anticiper les éventuelles difficultés à l’intubation. La prise en charge repose sur la ponction première sous anesthésie générale puis la marsupialisation de ce kyste afin de libérer les voies aériennes et d’éviter la survenue d’une récidive.
• Immobilité cordale
L’immobilité d’une ou des deux cordes vocales (ou immobilité glottique) est la 2e cause de stridor chez l’enfant, soit environ 10 % des pathologies congénitales du larynx. Elle peut être le fait :
– d’une atteinte neurologique entraînant une paralysie de la corde vocale ou une dyskinésie laryngée ;
– ou d’un blocage de la mobilité des cordes vocales telle une ankylose cricoaryténoïdienne.
Afin de pouvoir différencier les origines de cette immobilité, il est important de rechercher des éventuels antécédents chirurgicaux (canal artériel, malformation cardiaque), de dystocie ou d’intubation. Les étiologies les plus fréquentes sont idiopathiques (40 %), obstétricales (30 %), neurologiques (15 %) ou cardiaques (5 %) en cas de paralysie unilatérale. Les formes bilatérales, elles, sont congénitales dans 55 % des cas et associées le plus souvent à d’autres anomalies (neurologiques, hydrocéphalies, Arnold Chiari, myasthénie, etc.) ; acquises dans 45 % des cas, elles font suite à une intubation, une chirurgie cardiaque, une infection, etc.
La fibroscopie permet d’apprécier la mobilité des cordes vocales, l’existence d’une éventuelle compensation (fermeture plus marquée de la corde vocale mobile contre la corde vocale paralysée, par exemple), d’apprécier la largeur de la filière, l’aspect de la sous-glotte, et le passage salivaire au travers de la filière. Si une seule des deux cordes vocales est en fermeture, le stridor est alors parfois associé à une dyspnée majorée lors des efforts (cris, alimentation) mais peut être aussi bien toléré. Si les deux cordes vocales sont en fermeture, l’enfant présente en général une dyspnée aiguë pouvant rendre nécessaire une intubation en urgence. Les cordes dans ce cas sont plus souvent en position paramédiane, laissant une petite filière respiratoire.
La prise en charge peut comporter la mise en place d’une ventilation non invasive, une trachéotomie d’attente ou un geste laryngé effectué par voie endoscopique ou par voie cervicale externe (cordotomie, aryténoïdectomie, aryténoïdopexie, cricoid split, etc.). En cas de paralysie laryngée congénitale, on préfèrera des gestes conservateurs, la récupération pouvant se faire au cours des deux premières années de vie en général(7). Si la ou les cordes vocales est/sont en ouverture, plus rarement, l’enfant présente surtout une dysphonie avec une voix soufflée et des fausses routes aux liquides. Il faut alors épaissir les biberons. Si la dysphonie ne s’améliore pas et en cas de fausses routes invalidantes, on peut proposer une médialisation de la corde vocale, voire une réinnervation laryngée, exceptionnellement une trachéotomie.
• Hémangiome infantile
Il s’agit d’une tumeur vasculaire bénigne, 3e cause de stridor de l’enfant quand elle concerne le larynx. Des angiomes cutanées associés sont retrouvés dans 30-50 % des cas. Les facteurs de risque sont la prématurité, le sexe féminin, l’hypoxie ou le faible poids néonatal. Il se caractérise par une évolution triphasique : il apparaît dans les 3 premiers mois, augmente jusqu’à l’âge de 6-12 mois, puis s’en suit une phase de plateau jusqu’à 18 mois et enfin une involution progressive jusqu’à 7 ans. Il peut mimer une laryngite sous glottique car se présente comme une dyspnée inspiratoire entraînant, selon le degré d’atteinte des cordes et de la sous-glotte, une toux rauque et une modification de la voix. Sa corticosensibilité est trompeuse car il réapparait à distance de l’arrêt le faisant passer pour une récidive de laryngite.
La fibroscopie met en évidence une lésion framboisée, sous glottique, le plus souvent asymétrique en fer à cheval (figure 3). Elle permet aussi d’apprécier s’il existe une extension dans la paroi trachéale. Il faudra alors compléter le bilan par une IRM à la recherche d’une composante médiastinale. La prise en charge se fait par bêtabloquants qui induisent une régression de la prolifération tumorale et une disparition en quelques jours. Un cours traitement corticoïde peut y être associé au début(8,9). Ce traitement doit être maintenu jusqu’à au moins l’âge de 12 mois pour éviter l’effet rebond à l’arrêt.
• Sténose sous-glottique
Une sténose sous-glottique se caractérise par la diminution de la filière laryngée sous les cordes vocales : elle est le plus souvent acquise (80 %) suite à un traumatisme tel une intubation ou une brûlure. Elle est la conséquence d’une souffrance de la muqueuse qui s’ischémie et se nécrose, entraînant l’exposition du périchondre et une fibrose réactionnelle. Elle se crée le plus souvent au niveau du cricoïde car il s’agit d’une zone étroite définie par un anneau inextensible. Dans les autres cas, elle est congénitale (figure 3). Le principal diagnostic différentiel chez un enfant intubé à la naissance est la présence de kystes sous glottiques qui apparaissent souvent à distance de l’intubation. Une sténose peu sévère est souvent paucisymptomati que ; elle le devient quand le diamètre de la filière restante passe en dessous de 50 %. Devant une sténose, il est important d’en apprécier l’épaisseur par une endoscopie sous anesthésie générale, voire par un scanner si l’obstacle n’est pas franchissable. Le terrain doit aussi être évalué par la recherche d’associations malformatives, des notions de fausses routes, des troubles de déglutition. La prise en charge repose soit sur des gestes endoscopiques comme la dilatation par des ballonnets, soit par une approche externe (laryngoplastie d’ampliation) dont l’objectif est de restaurer la perméabilité de la lumière laryngée(10).
• Palmure laryngée
Une palmure se caractérise par la fusion plus ou moins épaisse des deux cordes vocales à leur partie antérieure (figure 3). Cliniquement, elle se manifeste par une dysphonie et une dyspnée si celle-ci est importante. La fibroscopie permet d’en apprécier l’aspect, l’épaisseur, l’éventuelle extension sous glottique antérieure et la filière restante. La prise en charge consiste à sectionner cette bride glottique lors d’une endoscopie sous anesthésie générale. Cette anomalie peut rentrer dans le cadre d’associations malformatives telles que la microdélétion 22q11, le VACTERL, le Klippel-Feil ; il faut donc effectuer un bilan complet et ne pas hésiter à adresser l’enfant en consultation génétique.
• Diastème
Le diastème est une malformation rare qui correspond à une communication anormale entre la trachée et l’œsophage ; elle peut ne concerner que la région interaryténoïdienne, une partie du cricoïde, la totalité de celui-ci ou une partie plus ou moins importante de la membraneuse trachéale postérieure et l’œsophage (figure 3). Il se traduit cliniquement par des épisodes de fausses routes survenant dès la naissance, pouvant entraîner des épisodes de cyanose ou de toux, ou encore de malaises. Il existe parfois un stridor inspiratoire, une dyspnée modérée, voire des épisodes d’infections pulmonaires. La fibroscopie permet d’évoquer le diagnostic mais il est nécessaire d’effectuer une endoscopie sous anesthésie générale pour apprécier la profondeur du diastème. Là encore, cette anomalie peut être associée à des tableaux malformatifs avec atrésie de l’œsophage, malformations cardiaques, fente vélopalatine, etc. La prise en charge sera d’autant plus délicate que le diastème est important et que les autres malformations seront nombreuses. Elle consiste à refermer la communication trachéo-œsophagienne(11).
• Chez l’enfant de plus de 6 mois
• Laryngite sous-glottique
Elle survient chez des enfants de 7 mois à 7 ans dans un contexte de rhinopharyngite et de fébricule. On décrit un début caractéristique le soir après le coucher, avec une bradypnée inspiratoire, un stridor, une toux rauque aboyante, voire une dysphonie si l’œdème affleure les cordes vocales. Selon la sévérité du tableau clinique, la prise en charge repose sur une corticothérapie soit per os, soit en aérosol, ou exceptionnellement, par voie intraveineuse en cas de dyspnée sévère. Dans les aérosols, on peut y associer de l’adrénaline dont le pic d’efficacité est plus précoce, permettant ainsi de soulager plus rapidement une dyspnée sévère. En l’absence d’amélioration au bout de 3 heures après la mise en route du traitement, l’enfant doit être hospitalisé. La fibroscopie laryngée n’est pas systématique ; elle n’est utile que dans les formes atypiques et chez les enfants de moins de 6 mois pour éliminer le diagnostic différentiel d’angiome.
• Papillomatose laryngée
La papillomatose laryngée récurrente est liée à la présence de virus du papilloma humain HPV 6 et 11. Il entraîne l’apparition de lésions exophytiques des voies aériennes (figure 3). Il s’agit de la 2e cause de dysphonie chez l’enfant. Le mécanisme de contamination de l’enfant par le virus n’est pas bien identifié ; il s’agit probablement d’une contamination anténatale. L’enfant peut présenter un stridor, une raucité de la voix, une détresse respiratoire selon l’importance de la prolifération papillomateuse, ou encore des signes évoquant de l’asthme, des laryngites. Ces signes étant peu spécifiques, il peut exister une grande errance diagnostique. La fibroscopie laryngée permet de redresser le diagnostic et orienter l’enfant vers une structure de prise en charge. L’endoscopie permettra le retrait de ces lésions et le typage viral. La survenue d’autant plus précoce, dans les 2 premières années, est associée à une évolution souvent plus agressive. Celle-ci est souvent imprévisible : on décrit des régressions spontanées dans 40 % des cas, une stabilisation, une récurrence après des années de rémission, ou encore une progression agressive avec une atteinte bronchopulmonaire, voire une transformation ma ligne. Peu de traitements médicaux ont montré la preuve d’une efficacité systématique.
Actuellement, la prise en charge repose sur des exérèses des lésions par voie endoscopique, dont la fréquence est dictée par le rythme d’apparition des lésions. Peut s’y adjoindre une injection locale de traitement antiviral, le cidofovir : cela permet d’espacer le délai entre deux endoscopies et ralentir la prolifération papillomateuse. L’espoir repose surtout sur la vaccination systématique des filles et des garçons, donc l’efficacité a été prouvée car elle réduit l’incidence de cette pathologie(12).
Nasofibroscopie au bloc opératoire
Une nasofibroscopie peut également être réalisée au bloc opératoire dans différentes indications.
• Syndrome de pénétration
La fibroscopie laryngo-trachéobronchique est l’examen de référence en cas de suspicion de syndrome de pénétration. Elle permet de visualiser l’ensemble des voies respiratoires jusqu’à la troisième division bronchique afin d’identifier le corps étranger inhalé(13). En cas de présence d’un corps étranger, une extraction peut être réalisée via le canal opérateur du fibroscope souple ou au cours d’une bronchoscopie rigide (lire également, l’article de G. Dutau).
• Endoscopie du sommeil
L’objectif de cet examen est d’induire l’enfant dans un sommeil artificiel, le plus proche possible du sommeil naturel. Un examen nasofibroscopique permet alors d’évaluer l’ensemble des sites obstructifs responsables du syndrome d’apnées obstructives du sommeil (SAOS). L’endoscopie du sommeil permet de démasquer certains obstacles non visibles en consultation (pharyngomalacie latérale, glossoptose, bascule épiglottique) (figure 5). Les indications sont nombreuses en pédiatrie : persistance d’un SAOS après chirurgie adénoamygdalienne ; SAOS chez un enfant avec comorbidités « à risque de récidive ou persistance de SAOS après chirurgie » (par exemple : trisomie 21, obésité, craniosténose, pathologie neurologique, etc.) ; SAOS sans hypertrophie des amygdales ni des végétations adénoïdes(14).
• Intubation difficile
Le nasofibroscope est d’une grande aide en cas d’intubation difficile. Il permet, chez un enfant dont le larynx n’est pas exposable par les moyens habituels (laryngoscope lame courbe ou droite, vidéo-laryngoscope), de visualiser le larynx puis d’intuber, en maintenant une ventilation spontanée. Parmi les pathologies à risques d’intubation difficile, on retiendra surtout la séquence de Pierre Robin (le retrognatisme et la glossoptose rendent l’exposition au laryngoscope malaisée et parfois impossible), les malformations crânio-faciales et maxillo-faciales complexes, et les lésions tumorales oropharyngées et supralaryngées.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :